mentara Na+
sebaliknya. Gradien ionik ini diyakini diatur oleh pompa
penukaran Na+/ K+
yang bermedia ATP ase. Konsentrasi Na+dan K+
intra selluler spermatozoa mammalia pada cauda epididimis yaitu sekitar 20 dan 14
mM. Perubahan konsentrasi selama kapasitasi masih belum diketahui.
Arus masuk secara besar-besaran dari Ca2+ ekstraselluler melalui selaput
kepala spermatozoa memicu terjadinya reaksi akrosom, akan tetapi masih sedikit diketahui tentang kinetika Ca2+ intraselluler selama kapasitasi. Pada
umumnya diterima anggapan bakwa konsentrasi Ca2+ intraselluler dalam spermatozoa yaitu cukup rendah, baik pada kepala maupun ekornya, dipicu
adanya mekanisme pemompa Ca2+ bermedia ATP ase dan pembuluh balik Na+/
K+
pada selaput plasma. Hilangnya ikatan Ca2+ pada permukaan spermatozoa,
bukan karena penetrasi ke dalam spermatozoa, dengan memakai queen2,
indikator luoresen yang selektif terhadap kalsium diketahui bahwa konsentrasi
ion Ca2+ intraselluler di dalam spermatozoa kelinci tidak berubah saat kapasitasi
secara in vitro. Teknik ini dipakai untuk menghitung kandungan ion
Ca2+ spermatozoa secara kelompok, bukan individu. Para peneliti menyebutkan bahwa konsentrasi ion Ca2+ mungkin berubah pada daerah tertentu atau
terlokalisir pada daerah tertentu. Hal ini merupakan hipotesa yang menarik,
karena peningkatan konsentrasi Ca2+ intraselluler selama kapasitasi menstimulasi adenilate cyclase spermatozoa yang mendukung pentingnya cAMP yang pada
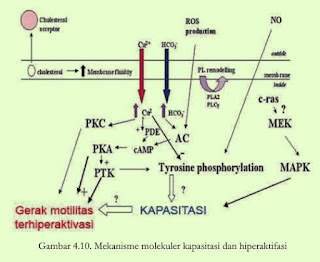
awal nya dibutuhkan untuk pembuahan. Seperti pada gambar 23, sedangkan
mekanisme molekuler yang lain ada pada gambar 24.
4. Perubahan pada akrosom
Struktur akrosom pada banyak spesies tidak berubah secara nyata
selama kapasitasi. Perkecualian dari tupai bulu emas, matriks akrosomnya
berubah segera sesudah spermatozoa mengalami kapasitasi. Alasannya belum
jelas, namun mungkin dipicu keluarnya beberapa molekul-molekul kecil
melalui plasma dan selaput akrosom terluar dan tidak diketahui mulainya dari
proses reaksi akrosom. Proses reaksi akrosom yaitu perubahan pro akrosin
yang tidak aktif secara enzim di dalam akrosom menjadi aktif secara enzim di dalam
akrosom. Hal ini dilakukan oleh glycosaminoglicans dalam uteri, tapi bagaimana cara
molekul besar glycosaminoglicans berpenetrasi ke dalam akrosom melalui selaput akrosom
dan plasma spermatozoa belum diketahui. Dan apakah enzim-enzim akrosom tetap dalam
bentuk inaktif atau berubah aktif selama kapasitasi berlangsung (sebelum reaksi akrosom)
masih menjadi pertanyaan.
5. Perubahan pada Inti
Inti spermatozoa pada kebanyakan mammalia merupakan struktur yang
sangat stabil dipicu cross-link oleh ikatan 5-5, tapi sedikit ekstensif dibandingkan dengan spesies lain. Pada plasma semen ada Zn2+ yang berasal dari
kelenjar prostat mengikat radikal bebas 5H+
dari protein inti spermatozoa saat
ejakulasi memicu stabilitas temporer pada protein inti. Selama kapasitasi
inti kehilangan ion Zn2+ dan stabilitasnya meningkat yang mungkin dipicu
oleh oksidasi pada radikal 5 H+
yang lepas pada ikatan disulida (Lelannou et
al, 1985)
6. Perubahan pada selaput Plasma
Selaput plasma berhubungan langsung pada lingkungan kapasitasi, sehingga terjadi perubahan mencolok pada selaput ini selama kapasitasi.
Pelepasan atau perubahan material-material pelapis permukaan spermatozoa
merupakan bagian terpenting dari kapasitasi, bukti-bukti yang mendukung
pendapat ini telah banyak.
Akrosom spermatozoa yang berasal dari kauda epididimis tikus mengandung antigen yang tak dapat dilepas dengan mudah dari permukaan spermatozoa dengan pencucian berulang-ulang, akan tetapi tidak ada saat spermatozoa
memasuki ruang vittelin sel telur dan antigen ini harus dilepas atau dirubah selama kapasitasi.
Menurut model “mosaik cairan” yang secara luas diterima pada selaputselaput biologis, protein-protein (atau glikoprotein) secara non kovalen berhubungan dengan lapisan ganda lipida yang membentuk matrik selaput. Proteinprotein intrinsik yang menempel dengan kuat pada lapisan ini dapat dilepas hanya
dengan perlakuan kasar (misalnya dengan detergen), sementara protein-protein
pembungkus yang berhubungan dengan selaput terutama melalui interaksi
elektrostatika dapat dilepaskan dengan sedikit penambahan “Chelating agent”
atau dengan penambahan pH atau kekuatan ionic. Glikoprotein-glikoprotein
yang dilepas dari dan atau ditambahkan pada permukaan spermatozoa selama
kapasitasi masih belum pasti diketahui. Salah satunya yaitu mungkin ibronectin
atau semacam ibronectin. Diduga ibronectin akan membekukan pergerakan lateralnya pada lapisan ganda lipida. Pelepasannya dari selaput ini memicu
protein intrinsik bergerak dengan bebas dalam lapisan ganda lipida.
Pengujian kerusakan selaput plasma sebelum dan sesudah kapasitasi yaitu
melalui Partikel-Partikel Intra Membran (IMPs) yang merupakan protein-protein
intrinsik pada lapisan ganda lipida berubah penyebarannya pada daerah kepala
maupun ekornya. IMPs yang menyebar hampir merata pada plasma membran
diatas akrosom spermatozoa marmut yang tidak kapasitasi, sedangkan pada
spermatozoa yang kapasitasi ada potongan-potongan kecil yang bebas
IMPs, demikian juga pada spermatozoa manusia. IMPs terkonsentrasi di dekat
helix mitokondria hanya ada pada spermatozoa yang tidak kapasitasi, selama
kapasitasi terjadi perubahan isika dan kimia pada lapisan ganda lipida.
Komposisi phospholipid membran plasma mengalami perubahan selama
kapasitasi, akan tetapi perhatian banyak tercurah pada kandungan kolesterol pada
plasma membran. Hal ini karena kolesterol memicu pengaruh yang sangat
jelas pada sifat semua sel biologis (Misalnya permeabilitas ion aktif dan pasif)
dengan mengatur luiditas dan ketebalan selaput lipida. Spermatozoa tikus pada
media kapasitasi akan kehilangan sebagian kolesterol, ini merupakan hal yang
penting pada proses kapasitasi, hal ini dipicu karena ada nya albumin
yang memicu penipisan kolesterol. Penipisan kolesterol ini tidaklah merata
dan hanya sedikit bagian yang bebas kolesterol. Hal ini mungkin karena pemisahan selaput lipida dan kolesterol secara lateral dari molekul-molekul ini
didalam lapisan ganda lipida untuk membantu domain dan bukannya terjadi arus keluarnya kolesterol dari selaput. Fluiditas lipida dari selaput membran
plasma kepala dan ekor spermatozoa mengalami perubahan akibat kapasitasi.
Perlu diingat bahwa sering kali dilakukan riset secara mikroskopis yang
ringan, perubahan luiditas yang kecil pada area terlokalisir mungkin merupakan
bagian terpenting yang sulit dideteksi (Yanagimachi, 1988)
ENZIM-ENZIM DALAM AKROSOM
Bentuk ikatan membran akrosom dengan struktur mirip topi yang menyelubungi daerah permukaan inti spermatozoa. Meskipun ukuran dan bentuk
dari akrosom bermacam-macam diantara spesies akan tetapi struktur dasarnya
sama. Akrosom diyakini analog dengan lysosom atau granul zymogen dari sel-sel
pancreas. Sebenarnya zat ini mengandung susunan enzim hydrolitik yang besar.
Meski beberapa dari enzim-enzim ini dapat terlokalisir di dalam atau permukaan akrosom, bukan di dalam matriks akrosom, enzim ini memiliki
kemampuan hidrolisa yang kuat.
Hyaluronidase dan akrosin yaitu dua jenis enzim akrosom yang telah
dipelajari secara luas dan terkarakteristik dengan baik. Keberadaannya di dalam
matrik akrosom telah ditunjukkan secara meyakinkan dengan teknik citokimia
atau immunocitokimia dengan memakai mikroskop elektron. Meski
beberapa peneliti menyatakan bahwa sebagian hyaluronidase akrosom dan akrosin bergabung dengan kuat pada selaput akrosom, akan tetapi bukti dengan
mikroskop elektron belum dapat ditunjukkan.
Karbohidrat merupakan komponen utama dari akrosom. Selaput tipis
glikoprotein yang menyelubungi permukaan sebelah dalam selaput terluar akrosom mungkin berfungsi untuk menjaga agar terjadinya plasma tervesukulasi dan
selaput akrosom secara bersama-sama selama reaksi akrosom. Glikoproteinglikoprotein lainnya dan zat-zat yang mengandung karbohidrat di dalam matriks
akrosom bisa membantu konversi enzim-enzim akrosom dari bentuk ion aktif
(misalnya proakrosin) menjadi bentuk aktif (misalnya akrosin).
ARTI FUNGSIONAL REAKSI AKROSOM
Sel telur dari kebanyakan binatang diselubungi oleh gliko protein, sehingga
spermatozoa harus menembusnya sebelum mencapai selaput plasma sel telur.
Pada beberapa invertebrata, “Lysin” yang dilepaskan akrosom spermatozoa
akan melarutkan lapisan sel telur secara lokal untuk menghasilkan lubang tempat
spermatozoa memasuki oosit.
Pelarutan lapisan oleh lysin dilakukan secara enzimatis atau interaksi
inter molekuler hidrofobik. Pada mammalia lapisan tebal glikoprotein ini
disebut dengan zona pellusida. Zona pellusida ini masih diselimuti oleh
kumulus oophorus yang tersusun dari sel-sel kumulus. Komponen utama kumulus yaitu asam hyaluronic. Hialuronidase yang dilepas oleh spermatozoa
bereaksi dengan akrosom, mencerna kumulus dan akrosin yang terbawa di
permukaan spermatozoa bereaksi dengan zona, sehingga spermatozoa dapat
masuk kedalam sel telur. Atau dengan kata lain reaksi akrosom sedikitnya bertujuan untuk (1) membantu spermatozoa menembus zona dan (2) Meleburkan
selaput plasma sel telur.
Gambaran Spermatozoa yang telah mengalami Reaksi Akrosom dengan
pewarnaan FITC Concanavaline A seperti pada gambar 4.2.
Pewarnaan FITC Concanavalin A pada prinsipnya yaitu pewarnaan
D-Mannosa yang terikat pada inner membrane akrosom, bila membrane
akrosom masih intak, maka pewarna/luoresen akan mewarnai bagian akrosom
dan bila spermatozoa sudah tidak ada akrosom, maka bagian atas kepala
spermatozoa berwarna gelap atau tidak ada pendaran luoresen.
4.3. MORFOLOGI DAN KINETIKA REAKSI AKROSOM.
1. Perbedaan antara Reaksi Akrosom “True” dan “False”.
Karena akrosom mengandung bermacam-macam enzim penghidrolisa
yang kuat, maka spermatozoa yang mati atau sekarat akan rusak membrannya
atau akrosomnya.
Membran akrosom yang terluar relatif stabil dan selaput plasma bagian
atas dapat dihancurkan sebagian atau keseluruhannya atau lepaskan dari
bagian utama spermatozoa. Spermatozoa tanpa akrosom bila diamati dengan
mikroskop cahaya sama dengan spermatozoa sesudah reaksi akrosom. Sangat
penting membedakan akrosom yang degeneratif dengan reaksi akrosom secara
isiologis
Banyak teknik untuk mengamati hilangnya, tetapi semua dilakukan pada
spermatozoa pada kondisi mati. Sangat diharapkan agar dikembangkan suatu
teknik baru yang dapat mengamati reaksi akrosom pada kondisi spermatozoa
hidup, sehingga dapat dibedakan spermatozoa tanpa akrosom karena faktor
degeneratif atau secara fungsional terjadi reaksi akrosom.
2. Sifat Alamiah Exocytotic pada Reaksi Akrosom
Reaksi akrosom selaput akrosom terluar dan selaput plasma bagian atas
yang memungkinkan isi akrosom untuk lepas.
Lokasi tempat penggabungan antara selaput plasma dan akrosom terluar
bermula terjadi dapat bervariasi menurut jenis spesies. Pada kelinci, letaknya
didaerah depan dan sekeliling daerah pembungkus akrosomal. Pada Tupai bulu
emas, biri-biri dan manusia letaknya di dekat perbatasan dari pembungkus akrosom dan equatorial akrosom. Hal ini tidak mengherankan sebab spermatozoa
pada banyak spesies selaput terluar akrosom dan selaput plasma tidak stabil,
dan selaput plasma terluar ini sangat kaya akan kalsium.
3. Waktu Reaksi Akrosom
Kecepatan reaksi akrosom tergantung dari spesiesnya, kondisi spermatozoa dan lingkungannya. Spermatozoa marmut dalam medium yang mengandung ion kalsium selesai dalam 2 menit. Spermatozoa tikus dan dipreinkubasi
dalam media kapasitasi selama 1 jam dapat berpenetrasi kedalam zona sebesar
15% menjelang 11 menit, sesudah 9 menit berikutnya 80% sel telur terpenetrasi.
Kemungkinan besar spermatozoa melebur seluruhnya pada saat pertama kali
menyentuh zona pellusida. Setidaknya beberapa spermatozoa memulai dan menyelesaikan reaksi akrosom 10-15 menit saat bersentuhan dengan zona. Semua
fakta ini kelihatannya mengindikasikan bahwa spermatozoa berkapasitasi
dan mengalami reaksi akrosom secara tepat.
4. Faktor pemicu alami reaksi akrosom
Sel telur landak laut diselubungi selaput tipis glycoprotein yang disebut
dengan lapisan vitelline dan masih diselubungi lagi dengan lapisan jelly yang
tebal. Lapisan vitelline ini homolog dengan zona pellusida dari sel
telur mammalia, sedangkan jelly ini homolog dengan sel-sel kumulus
dari mammalia. Pada banyak spesies landak laut, reaksi akrosom terjadi saat
spermatozoa menyentuh jelly atau saat spermatozoa melewatinya. Secara
biokimia, jelly yaitu campuran glycoprotein dan polimer sulfat fucose. Reaksi
akrosom terjadi karena jelly mengandung sulfa, sedangkan mekanismenya
masih belum jelas. Pengikatan komponen-komponen jelly yang aktif pada
protein selaput plasma spermatozoa memicu perubahan permeabilitas
ion kalsium temporer.
Faktor yang memicu reaksi akrosom pada mammalia tampaknya
yaitu kumulus oophorus dan atau zona pelusida. Pada waktu spermatozoa
menempel pada zona pellusida kemudian mengalami reaksi akrosom, karena
materi-materi pada zona memicu terjadinya reaksi akrosom dengan eisien.
Satu dari tiga glikoprotein zona yaitu ZP3 yang mengikat selaput plasma di
luar pembungkus akrosom. Rantai polypeptida dalam molekul ZP3 tampaknya
berfungsi sebagai pemicu dari reaksi akrosom.
Apakah kumulus oophorus memiliki kemampuan untuk memicu
terjadinya reaksi akrosom masih kontroversial, Adanya kumulus pada media
yang kekurangan albumin dapat meningkatkan keberhasilan pembuahan, akan
tetapi tidak ada bukti yang jelas tentang pengaruh sel kumulus terhadap reaksi
akrosom, akan tetapi kemungkinan komponen kumulus mengawali terjadinya
reaksi akrosom dan komponen ini bekerjasama dengan zona untuk menyelesaikan reaksi akrosom.
Pemicu reaksi akrosom bukannya suatu substansi khusus, sebagai contoh
reaksi akrosom landak laut dapat dipacu dengan bahan kimia dan isika, sedangkan mamalia dapat mengalami reaksi akrosom tanpa adanya sel telur dan materi
yang berhubungan dengan sel telur (Misal sel kumulus dan zona). Bahan-bahan
yang secara langsung atau tidak langsung merubah permeabilitas membran
akrosom terhadap ion-ion (Misal Ca++ dan Na++), sehingga spermatozoa yang
berkapasitasi mengalami reaksi akrosom.
Reaksi akrosom diinduksi oleh bertemunya reseptor membran spermatozoa dengan ZP3, salah satu protein dalam ZP3 yaitu galaktosil transferase 1
(GaLT-1), suatu enzim intra membranosa yang memiliki lokasi aktif di permukaan dan selanjutnya akan mengikat residu karbohidrat pada ZP3. Setiap
ZP3 dapat mengikat dua atau tiga molekul GaLT-1 (Miller et al , 1992). Ikatan
ini mengaktifkan G-protein spesiik pada membran spermatozoa serta
phospholipase C (PLC) yang memicu depolarisasi membran, sehingga
membukanya channel Ca2+. Kondisi ini akan meningkatkan konsentrasi Ca2+
dalam sitoplasma dan pH meningkat, sehingga vesikula akrosom mengalami
eksositosis (Shi et al , 2001; Florman et al , 1998) Selanjutnya beberapa komponen signal transduksi yang berperan dalam inisiasi reaksi akrosom yaitu G
protein, inositol-3,4,5 triphosphat (IP3) dan reseptor IP3, Phospholipasi C,
Ca2+, saluran Ca2+ (channel Ca2+/tipe T) yang sensitif terhadap permeabilitas
membran sel (Florman et al, 1998).
Eksositosis dari vesikula akrosom melepaskan bermacam-macam
protease, sehingga melisiskan Zona Pellusida. Enzim ini menimbulkan suatu
lubang/pori yang akan dilewati spermatozoa sehingga sapat masuk ke membran
sel telur (Shi et al, 2001)
4. Mekanisme Reaksi Akrosom
Spermatozoa landak laut tidak mengalami kapasitasi seperti pada mammalia, spermatozoa siap membuahi sel telur sesudah keluar dari pejantan. Pada
kebanyakan spermatozoa dari spesies landak laut mengalami reaksi akrosom
di dalam jelly sel telur. Jelly sel telur yang diduga berinteraksi dengan reseptor
selaput plasma melewati dua lintasan parallel. Salah satunya yaitu lintasan yang
tak bergantung ion kalsium yang mengarah pada peningkatan pH intraselluler
lewat arus masuk Na++ dan arus keluar H+
. Satunya yaitu depolarisasi selaput
yang bergantung pada ion Ca++ dan peningkatan pH intraselluler yang meng
hasilkan arus besar-besaran ion Ca++ ekstraselluler. Ion Ca++ yang berpenetrasi
pada selaput plasma memicu penggabungan antara plasma dan selaput akrosom
terluar, mencapai puncaknya dalam suatu eksositosis kandungan akrosom. Meski
konsentrasi cAMP intraselluler dari spermatozoa landak laut dalam kondisi yang
mendukung reaksi akrosom dan hubungan yang pasti antara cAMP dengan
reaksi akrosom belum jelas.
Arus masuk nya ion Ca++ merupakan tahap penting dari reaksi akrosom
spermatozoa mammalia. Jelas sekali bahwa semua komponen yang berada di
dalam dan di luar akrosom terlibat langsung pada proses reaksi akrosom. Untuk
menjalani reaksi akrosom pada waktu dan tempat yang tepat, maka spermatozoa
mammalia harus dapat bertahan hidup lama. Konsentrasi ion K+
intraselluler
dijaga tetap tinggi dan konsentrasi ion Ca++ dan Na+
intraselluler dijaga tetap
rendah, hal ini sangat penting untuk kelangsungan hidup spermatozoa dan
perlindungan spermatozoa dari reaksi akrosom dini. Semua ini dilakukan oleh
ikatan membran Na+
- K+
ATP ase (yang memompa ion Na+
keluar dan ion K+
ke dalam sel) dan Ca++ -ATP ase ( yang memompa Ca++ keluar dari sel). Selama
kapasitasi, lapisan permukaan makromolekul spermatozoa dilepas atau dirubah, sehingga protein-protein membran intrinsik (termasuk zona atau reseptor
kumulus dalam selaput plasma spermatozoa diatas akrosom) menjadi berubah.
Pelepasan ini memicu protein membran intrinsik dapat bergerak
lebih bebas di dalam lapisan ganda lipida. Lapisan ganda lipida sendiri merubah
susunan molekulernya selama kapasitasi yang dilakukan oleh faktor-faktor endogen dan eksogen. Albumin merupakan satu dari faktor-faktor eksogen yang
bertanggung jawab pada pengorganisasian kembali lipida-lipida membran saat Glicosaminoglicans sel kumulus atau glicoprotein zona pellusida mengikat
reseptor. Zona atau reseptor kumulus ini berupa protein pembawa ion Ca++
,
reseptor membantu difusi ion Ca++ ekstra selluler. Arus masuk ion Ca++ besarbesaran menonaktifkan Na+
-K+
-ATP ase, sehingga meningkatkan konsentrasi
ion Na+
intraselluler. Hal ini memicu arus keluar ion H+
(melalui pembuluh balik Na+/H+
) yang memicu pH intra selluler naik. Ion Ca++ yang
telah berpenetrasi akan bekerja dengan atau tanpa calmodulin pada selaput
plasma. Ion Ca++ membantu penggabungan antara kedua membran dengan
perlekatan pada phospolipid dan memicu pemisahan phospoliphid membran.
Phospholidase-phospholidase aktif menyerang phospolipid-phospolipid untuk menghasilkan produk-produk gabungan (misalnya asam arachidonic dan
phospholipid). Saat membran akan bergabung atau telah bergabung, ion Ca++
masuk dan ion H+
keluar dari matrik akrosom. Hal ini memicu perubahan
proacrosin menjadi akrosin aktif secara enzim dan mendispersi akrosom yang
mengandung enzim-enzim lainnya.
Spermatozoa mammalia memulai reaksi akrosomnya secara spontan
dalam media kapasitasi spermatozoa, hal ini dipicu oleh (a) Aktivasi spon
tan dari zona oleh reseptor-reseptor kumulus atau protein pembawa ion Ca++
dalam membran plasma spermatozoa atau oleh (b) Penonaktifan mekanisme
pemompa ion Ca++ (Ca++-ATP ase). Pada spermatozoa yang sekarat atau mati,
ion-ion intraselluler akan mengalir keluar dan ion-ion eksternal berpenetrasi
dengan bebas ke dalam sel. Hal ini dipicu oleh lemah atau non aktifnya ATP
ase. Acrosin dan enzim-enzim akrosomal lainnya akan menyerang membran
spermatozoa yang memicu hilangnya sebagian atau seluruh pembungkus
akrosom. Hal ini disebut dengan reaksi akrosom “false”.
Hiperaktifasi Spermatozoa
Spermatozoa pada beberapa spesies mulai bergerak sangat aktif sebelum
berlangsungnya reaksi akrosom yang disebut hiperaktivasi. Istilah ini untuk
membedakan dengan kata aktivasi yang menunjukkan gerak aktif dari epididimis
saat bertemu dengan seminal plasma.
Spermatozoa mulai bergerak sangat aktif saat kontak dengan media
kapasitasi, beberapa jam bergerak sangat kaku kemudian bergerak bebas. Mula mula spermatozoa berenang dalam bentuk linier mulai menunjukkan gerakan
tunggal yang ditandai dengan gerakan ekor seperti tali cambuk dan dihentikan
dengan gerakan lurus-lurus pendek. Kedua tipe ini secara gabungan disebut
hiperaktivasi. Motilitas spermatozoa terhiperaktivasi secara in vitro sama dengan
secara in vivo yaitu pergerakan dalam oviduct saat fertilisasi.
Spermatozoa secara in vivo memulai gerakan hiperaktivasi, terjadi di
beberapa tempat dan beberapa spesies terjadi di dalam istmus. Saat hiperaktivasi ini spermatozoa memiliki daya dorong yang tinggi, hal ini selain untuk
bergerak menuju ampulla juga untuk menembus zona pellusida yang keras,
dan ada korelasi positif antara motilitas spermatozoa terhiperaktivasi dengan
kemampuan spermatozoa menembus zona. Komponen-komponen medium
secara keseluruhan mempengaruhi inisiasi dan mempertahankan motilitas
spermatozoa yang hiperaktivasi, misalnya Ca++, HCO3
, K+
, substrat energi dan
albumin, semuanya untuk mengontrol hiperaktivasi.
Tidak ada basis molekuler pada hiperaktivasi, sebab beberapa makromolekul yang menutup membran plasma dipindahkan selama kapasitasi.
Membran plasma ekor spermatozoa pre hiperaktivasi mengalami perubahan
karakteristik isik dan kimia lipida membran ekor selama kapasitasi. Salah satu
perubahan lipid membran yaitu methylsi phospholipid. Methylsi phospholipid membantu masuknya Ca++ ke dalam sel, peningkatan Ca++ yang masuk
kedalam membran spermatozoa merangsang adenylate cyclase yang menghasilkan
cAMP. Ca++ dan cAMP yaitu yang mengatur pergerakan ekor spermatozoa.
Spermatozoa hiperhativasi pergerakan ekornya kaku, sedangkan spermatozoa
yang telah hiperaktivasi bergerak lentur atau terbebas dari kebekuan. Hal ini
dipicu oleh menghalusnya serat kasar bagian luar oleh Mg-ATP, hal ini
dibuktikan dengan terhiperaktivasinya kembali spermatozoa sesudah diberi MgATP ke serat-serat spermatozoa.
Proses fertilisasi yaitu suatu peristiwa secara seri mulai dari penempelan
spermatozoa pada oosit, penembusan zona pelusida, perivitellin, sitoplasma
hingga fusinya pronuclei yang berasal dari spermatozoa dengan pronuclei yang
berasal dari oosit.
Spermatozoa banyak mengalami perubahan isiologi di membran sel
mulai dari proses spermatogenesis hingga terjadinya fertilisasi. Fertilisasi merupakan awal dimulainya proses perubahan dari sel tunggal menjadi organisme
multi selluler (Evans, 2001).
Perubahan atau perkembangan dari spermatozoa ini terjadi beberapa mekanisme yaitu: 1) Proses biosintesis sel-sel spermatogenik sebelum
proses meiosis (2) Mekanisme kontak langsung antara sel sertoli pada proses
spermatogenesis (3) interaksi spermatozoa dengan seminal plasma dan proses
pematangan di epididimis serta saat interaksi dengan cairan dalam saluran reproduksi betina dan kapasitasi (4) mekanisme fertilisasi (Thaller and Cardullo,
1990)
Proses fertilisasi terdiri dari 4 tahap yaitu: (1) Kontak dan pengenalan
antara spermatozoa dengan sel telur (2) Proses masuknya spermatozoa sel telur
(3) Fusi materi genetik spermatozoa dengan sel telur serta (4) aktivasi metabolisme zigot untuk memulai perkembangannya (Hinsch et al, 1994)
PENETRASI SPERMATOZOA PADA SEL TELUR
Sel telur dilindungi oleh sel pelindung, sel pelindung terluar yaitu zona
pelusida yang relatif tebal yang bersifat elastis dan tersusun oleh glicoprotein.
Pada mammalia zona pelusida masih dikelilingi oleh kumulus oophorus saat
terjadinya fertilisasi in vitro. Kumulus tersusun dari komponen selluler dan
aselluler. Karbohidrat (termasuk asam hyaluronat) dan protein merupakan
komponen utama dari kumulus. Pada domba, sapi dan binatang berkantung
ada kumulus sesudah ovulasi dalam waktu singkat, sehingga zona merupakan
satu-satunya pelindung sel telur dan spermatozoa harus mampu menembusnya
sebelum mencapai plasma telur.
5.2. PENETRASI SPERMATOZOA DALAM MENEMBUS KUMULUS OOPHORUS
Di saat banyak spermatozoa berenang mengelilingi masing-masing sel
telur untuk menghamburkan kumulus, maka salah satu spermatozoa melakukan
penetrasi ke dalam sel telur. Sering kali spermatozoa tidak dijumpai pada lumen
kumulus akan tetapi sudah terjadi penetrasi, hal ini menunjukkan bahwa proses
penetrasi ini sangat eisien di dalam ampulla.
Spermatozoa yang menembus ke dalam sel kumulus harus sudah mengalami kapasitasi dan ada acrosomal caps, hal ini karena bila spermatozoa
berada di dalam sel kumulus dalam keadaan belum kapasitasi, maka spermatozoa
ini tidak akan mampu melakukan penetrasi ke dalam zona.
Bagaimana spermatozoa terkapasitasi menembus kumulus untuk mencapai permukaan zona pellusida? Apakah reaksi akrosom dan enzim-enzim
akrosom terlibat dalam proses ini? Membran plasma spermatozoa membawa
enzim hyaluronidase untuk penetrasi kedalam kumulus, Hal ini banyak
diyakini orang, akan tetapi tidak ada bukti yang kuat. Kemungkinan enzimenzim akrosom keluar melalui akrosom luar dan membran plasma, sedangkan
enzim-enzim selain hyaluronidase yaitu yang dapat melisis kumulus belum
diketahui.
Fungsi yang tepat dari hyaluronidase dalam fertilisasi masih kontroversi. Hyaluronidase sudah lama sekali dapat teridentiikasi dan terkarakterisasi.
Hyaluronidase sapi tidak memiliki fungsi biologis karena (a) Hyaluronidase
tidak mampu menghamburkan sel-sel kumulus yang menyelubungi oosit (b)
Oosit mengalir secara spontan di dalam oviduct tanpa pengaruh hyaluronidase,
sehingga para peneliti menyimpulkan enzim dari akrosom ini tidak berfungsi
pada spesies ini. Hyaluronidase berfungsi dalam depolimerisasi asam hyaluro-
nat dari sel kumulus sehinga dikatakan hyaluronidase juga berperanan dalam
penetrasi spermatozoa.
Aksi penghambatan fertilisasi oleh andibodi-antihyaluronidase lebih
banyak di zona dari pada sel kumulus. Myocrisin (Na-aurothiomalat suatu inhibitor hyaluronidase) menghambat masuknya spermatozoa yang terkapasitasi
walaupun motilitasnya tinggi. Dengan daya ini spermatozoa lengket pada sel
kumulus, sehingga tidak dapat menerobos ke dalam sel kumulus. Hialuronidase
dapat bertindak sebagai lumbrikan bagi spermatozoa yang masuk melalui sel
kumulus. Jika hialuronidase diperlukan untuk penetrasi kumulus, maka berarti
ada ikatan diantara keduanya yang mengembalikan kemampuan spermatozoa untuk menembus kumulus.
PENETRASI SPERMATOZOA KE DALAM ZONA PELLUSIDA.
1. Karakteristik Kimia Zona Pellusida
Zona pelusida merupakan suatu glikoprotein. Sebagai contoh zona babi
meliputi protein 71%, Heksosa netral 19%, asam sialat 2,7% dan sulfat 2,7%.
Zona babi ada empat golongan glycoprotein yaitu: ZP1 (BM=82.000);
ZP2 (BM=61.000); ZP3 (BM=55.000) dan ZP4 (BM=21.000). Zona Tikus
memiliki 3 macam zona yaitu ZP1 (BM=200.000), ZP2 (BM=120.000),
ZP3 (BM=83.000), zona hamster juga ada tiga yaitu ZP1 (BM=240.000),
ZP2 (BM=150.000) dan ZP3 (BM=80.000). Pada tiap spesies juga ada
perbedaan berat molekul, perbedaan ini bisa terjadi bila memakai teknik yang berbeda. Integritas struktur zona tampaknya dipertahankan
oleh kekuatan non kovalen meskipun ada beberapa ikatan disulida molekuler.
Bagaimana golongan glykoprotein yang berbeda di distribusikan dalam zona
masih belum diketahui sepenuhnya, tetapi sebagai contoh glikoprotein ZP2 dari
zona tikus didistribusikan pada zona yang paling tebal. Pada babi ZP1, ZP2
dan ZP3 semua terletak pada permukaan yang bila diamati dengan mikroskop
scanning luar pemukaannya ada tempat untuk penetrasi berupa kisi-kisi
yang tidak teratur.
Zona tidak mengalami perubahan selama proses maturasi sel telur sampai
terjadinya ovulasi, zona kehilangan glycosaminoglicans beberapa jam sebelum
ovulasi. Pada saat sel telur ditransportasikan dari ovarium ke oviduk, maka oleh
oviduk ditambahkan glikoprotein. Diketahui pada banyak spesies penyusun
zona berubah drastis pada saat fertilisasi, sehingga spermatozoa yang lain tidak
bisa menerobosnya. Hal ini disebut dengan reaksi zona. Pada reaksi ini yaitu
hidrolisis glikoprotein ZP2 dan ZP3 oleh granula cortical. Akan tetapi pada
mammalia reaksinya tidak kuat. Pada beberapa spesies, misalnya tikus dan kelinci
zona kembali dapat dipenetrasi oleh beberapa spermatozoa pada beberapa jam
sesudah ada spermatozoa yang masuk ke dalam sel telur. Meskipun susunan kimia
zona berubah karena hasil hidrolisa dari granula cortical.
2. Penyerangan Spermatozoa Pada Zona
Spermatozoa yang fertil akan menempel erat pada zona sebelum penetrasi
kedalamnya. Ikatan zona-spermatozoa yang kuat ini karena adanya interaksi
antara molekul spermatozoa dengan zona. Gwatkin dan Williams berpendapat
bahwa keberadaan zona terlarut dalam media fertilisasi akan mencegah kapasitasinya spermatozoa. Zona terlarut tampaknya tidak mempengaruhi pergerakan
spermatozoa. Hal ini karena permukaan spermatozoa terjadi penjenuhan reseptor molekul-molekul zona yang memicu spermatozoa tidak mengenali
zona yang asli, sehingga dapat dikatakan bahwa membran spermatozoa membawa glikoprotein dengan ainitas yang kuat ke molekul zona.
Molekul-molekul zona yang bertanggung jawab terhadap ikatan spermatozoa dan zona telah diteliti secara luas pada tikus oleh Wassarman dan
kelompoknya. Glikoprotein ZP3 dan ZP2, bukan ZP1 yang memiliki aktivitas
reseptor spermatozoa. ZP3 yaitu reseptor spermatozoa yang utama, sedangkan
ZP2 yaitu reseptor sekunder. ZP3 yaitu reseptor sperma yang memiliki
aktivitas menginduksi reaksi akrosom pada bagian rantai sakarida-O. ZP3 bertanggung jawab terhadap aktivitas reseptor utama, sedangkan polipeptidanya
terlibat dalam fungsi induksi-reaksi akrosom glikoprotein.
Spermatozoa hasil ejakulasi atau dari epididimis mengikat sel telur secara
homolog atau heterolog. Tampaknya spermatozoa yang belum masak dari epididimis mampu menempel erat pada zona. Apakah ini berarti bahwa reseptorreseptor zona pada spermatozoa disusun pada permukaan spermatozoa dan
siap mempengaruhi zona jauh sebelum spermatozoa membuahi sel telur? Paling
tidak ada beberapa materi penutup permukaan spermatozoa yang dirubah selama
pematangan. Pada kondisi alami, hanya spermatozoa yang mengalami kapasitasi
spermatozoa secara penuh saja yang dapat bertemu dengan zona, sehingga untuk
mengenali reseptor zona harus pada spermatozoa yang terkapasitasi.
Keberadaan material pengikat pectin pada membran spermatozoa terkapasitasi dan pada plasma membran akrosom bagian dalam dari spermatozoa
yang telah reaksi akrosom ada beberapa glikoprotein integral yang didapatkan selama kapasitasi dan reaksi akrosom. Sampai saat ini masih belum jelas
secara keseluruhan apakah reseptor zona pada spermatozoa berupa protein,
glikoprotein atau komponen-komponen glikoprotein. Sakarida-sakarida terminal
glikoprotein misalnya N-asetil-D-glukosamin, mannosa, fruktosa, galaktosa
dan asam sialat memiliki aktiitas-aktiitas reseptor. Beberapa peneliti yang
lain mengatakan berpendapat bahwa protein-protein membran memiliki
aktiitas reseptor zona. Ikatan protein-fruktosa pada membran spermatozoa
babi merupakan reseptor zona, tetapi ada lagi yang menyatakan bahwa protein
dengan glikoreansferase atau dengan aktiitas protein dapat bertindak sebagai
reseptor zona pada spermatozoa. Peptida-peptida yang dihasilkan dari autokatalisis akrosin bertindak sebagai reseptor zona pada spermatozoa.
Di mana letak reseptor-reseptor zona pada spermatozoa? Sebelum
menjawab pertanyaan ini ada baiknya bila kita membicarakan struktur mana
pada spermatozoa yang melakukan kontak dengan zona. Pada tikus ada
pada membran plasma diatas akrosom. Hanya spermatozoa yang memiliki
akrosom sempurna yang dapat melekat pada permukaan zona. Spermatozoa
yang telah tereaksi yaitu yang telah hilang membran plasma bagian luar penutup
akrosom tidak akan mampu mengikat zona. Dengan kata lain bahwa membran
plasma di atas penutup akrosom yaitu reseptor zona, akan tetapi dengan mencuci spermatozoa dengan sentrifugasi gradien dextran, sehingga akrosomnya
tereaksi, kemudian spermatozoa dipertemukan dengan sel telur sehingga ada ikatan yang lemah antara spermatozoa dengan zona. Pada Golden Hamster,
pada spermatozoa yang belum dan sudah tereaksi akrosom dapat menyerang
zona, dengan kata lain reseptor zona yang ada di spermatozoa tidak hanya pada
plasma membran diatas penutup akrosom, tetapi juga pada tempat yang lainnya
dari kepala spermatozoa atau membran akrosom bagian dalam.
Apakah tempat reseptor zona berbeda diantara spesies? reseptor zona pada
spermatozoa yang terkapasitasi terletak pada bagian atas akrosom, sedangkan reseptor ZP terletak pada bagian dalam akrosom. Hal ini menunjukkan bahwa pada
permukaan spermatozoa ada tipe reseptor yang berbeda yang menjadi aktif
dan tidak aktif selama interaksi antara zona dengan spermatozoa. Jika spermatozoa hanya memiliki satu type reseptor zona pada membran plasma di atas
penutup akrosom, maka spermatozoa yang telah mengalami reaksi akrosom yaitu
spermatozoa yang telah kehilangan membran plasma penutup akrosom tidak
akan dapat melakukan penetrasi sel telur. Yang penting reseptor spermatozoa
ada pada permukaan spermatozoa yang akan tereaksi dan terjadi ikatan
yang lunak dengan sel telur, sebab bila ikatan itu kuat maka spermatozoa tidak
bisa menembus sel telur dan hanya menempel pada zonanya saja
Membran plasma di seluruh kepala spermatozoa kelinci memiliki
reseptor zona. sesudah reaksi akrosom, reseptor-reseptor zona ini ada di
sisi depan. Segmen equatorial dan bagian depan daerah pasca akrosom. Selama
fertilisasi spermatozoa kelinci harus memakai reseptor zona pada membran
plasma akrosom pertama, kemudian membran plasma setengah bagian belakang
spermatozoa untuk mengikat zona. Spermatozoa harus memakai reseptor
zona yang terletak pada membran plasma bagian belakang kepala spermatozoa
untuk mengikat zona.
3. Bagaimana reseptor-reseptor spermatozoa pada zona dan reseptor- reseptor zona saling berinteraksi satu dengan lainnya?
Reseptor spermatozoa pada zona dan reseptor zona pada spermatozoa
menjadi pelengkap satu dengan lainnya. Aktivitas reseptor spermatozoa menempati oligosakarida pada rantai O pada salah satu glikoprotein zona yaitu
ZP3. Oligo sakarida ini mengandung N-acetyl-D-Glucosamine, asam sialat,
fruktosa dan atau galaktosa yang menyusun bagian-bagian aktif reseptor spermatozoa pada zona.
Reseptor-reseptor zona pada spermatozoa merupakan lectin protein
dengan sakarida sebagai aktivitas pengikat. Beberapa protein yang diisolasi
dari spermatozoa diketahui memiliki kemampuan untuk mengikat molekulmolekul zona, tetapi tidak jelas apakah reseptor zona merupakan protein murni
atau protein konjugasi. Banyak yang menyatakan reaksi zona menempati bagian
protein, tetapi Shur dan kelompoknya menyatakan bahwa galactose transferase
merupakan reseptor zona pada zona dan terminal N-acetyl-D-Glucosamine merupakan reseptor spermatozoa pelengkap zona. Ikatan spermatozoa–zona terjadi
dalam bentuk enzim substrat yaitu sialil transferase spermatozoa dan asam sialat
zona berinteraksi pada ikatan zona-spermatozoa.
ada keterlibatan tripsin pada ikatan spermatozoa-zona dan ada
inhibitor dari proteinase. Molekul-molekul non enzim dapat sebagai pengikat
zona yang kemungkinan berada di membran plasma, karena spermatozoa yang
terkapasitasi sesudah menempel pada zona akan menyelesaikan reaksi akrosomnya. Macam dari molekul ini masih dalam pertanyaan.
4. Penetrasi spermatozoa dalam Menembus Zona Pellusida
Spermatozoa yang mengalami reaksi akrosom dalam aksinya menembus
zona akan kehilangan semua komponen akrosomnya, kecuali segmen equator
dan membran akrosom bagian dalam yang menutup bagian depan. Setengah
kepala yang berhubungan langsung dengan material zona dan menembus zona
dengan menggerakkan ekornya secara kuat. Gerakan ekor yang kuat ini
penting untuk keberhasilan penetrasi zona, yang diikuti dengan gerakan memotong sisi ke sisi dan gerakan maju dan mundur dari kepala spermatozoa.
Spermatozoa yang membuahi selalu meninggalkan celah penetrasi yang tajam
dan tipis secara vertical dalam menembus zona.
Ada beberapa hipotesis tentang penembusan spermatozoa ke zona:
1. Hipotesa mekanik
Penembusan spermatozoa dalam sel telur benar-benar secara mekanik.
Satu-satunya tujuan reaksi akrosom yaitu membuka lubang pada akrosom.
Kemudian membuat titik lubang yang tajam dan membuka zona secara mekanik
sejalan dengan cara menggerakkan ekor spermatozoa secara kuat.
2. Hipotesa enzimatis
Berlawanan dengan hipotesis diatas, setiap tahap alasan spermatozoa
dalam menerobos pelindung telur tergantung enzim. Hyaluronidase akrosom
dilepas selama aliran spermatozoa menembus kumulus. Beberapa enzim lain di
permukaan spermatozoa membantu ikatan antara zona dengan spermatozoa.
Akrosin tidak menghancurkan zona, tetapi menghidrolisa glikoprotein
zona yang spesiik untuk melunakkan zona. Ikatan enzim-enzim ini memecah
molekul zona sejalan dengan gerakan spermatozoa yang kuat. Kemungkinan
ikatan lisin itu meliputi akrosin, proteinase yang bukan akrosin, hyaluronidase,
Aryesulfatase, glycosulfatase dan N-asetylhexosaminidase.
Hipotesis mekanik berdasarkan pertimbangan sebagai berikut:
Secara teoritis, tenaga yang dipakai spermatozoa bisa sebesar 100PN. Hal ini
cukup besar untuk pembebasan tekanan dari hubungan non kovalen glikoprotein
zona yang bertindak sebagai cairan viscoelastis.
1. Celah penetrasi spermatozoa memiliki batas yang jelas, seolah-olah
memotong zona.
2. Zona kelinci sesudah dicerna tripsin dan akrosin masih dapat dipenetrasi.
3. Protein inhibitor menghalangi penempelan spermatozoa di permukaan
zona, tetapi sekali ikatan terjadi maka spermatozoa dapat menerobos
zona.
Jika spermatozoa mammalia menerobos pelindung tanpa bantuan enzim,
mengapa akrosom memiliki enzim-enzim yang kuat, seperti hyaluronisade
dan akrosin yang mampu menghidrolisa matrik kumulus dan zona. Jika akrosom
dan enzim merupakan kekuatan evolusi, maka kita harus menemukan beberapa
spesies mammalia yang spermatozoanya secara total tidak memiliki akrosom atau enzim-enzim akrosom. Oleh sebab itu akrosom dan enzimnya harus
memiliki fungsi yang sangat penting.
Hipotesa enzimatis juga memiliki titik kelemahan, jika penetrasi kumu-
lus tergantung sepenuhnya pada hyaluronidase, maka pada spermatozoa yang
tidak memiliki enzim ini (Sea urching dan Rooster) pasti tidak menembus
kumulus. Spermatozoa binatang berkantung dan burung melepaskan enzim
akrosom (termasuk hyaluronidase dan akrosin) pada permukaan zona untuk
melunakkan zona sebelum spermatozoa memasukinya.
Enzim-enzim pada akrosom berperanan penting pada tahap awal pemasukan spermatozoa kedalam zona. Spermatozoa manusia melakukan penetrasi
ke dalam lendir servik lebih eisien jika spermatozoa dalam seminal plasma dari
pada jika berada dalam larutan garam buatan. Enzim-enzim seminal membantu
spermatozoa ke dalam lendir servik. Enzim akrosom yang dilepaskan oleh
spermatozoa pada permukaan zona akan membantu masuknya spermatozoa
ke dalam zona. Jumlah enzim akrosom yang diperlukan untuk pemasukan awal
ini bervariasi pada spesies yang berbeda.
Yang paling mungkin yaitu spermatozoa memakai sarana mekanik dan enzimatis untuk menembus zona. Spermatozoa tidak pernah bisa
menerobos zona yang keras jika dalam keadaan immotil atau sedikit motil.
Spermatozoa harus memiliki daya dorong yang kuat untuk dapat menembus
zona. Materi-materi akrosom termasuk enzim yang jalan aliran spermatozoa.
Beberapa materi akrosom yang dilepas bisa merubah molekul-molekul zona
atau melunakkan zona agar dapat dipenetrasi.
Arand dkk mengusulkan hipotesis ikat lepas interaksi spermatozoa.
Pertama-tama protein terikat zona-spermatozoa (ZBP) yang memiliki ikatan
dengan ainitas tinggi diikuti dengan degradasi tinggi dan pelepasan ikatan ZP
oleh enzim-enzim spermatozoa. ZBP ini mengikat ZP yang baru tanpa
gerak maju spermatozoa. penetrasi tidak akan terjadi jika aktiitas enzimatis
spermatozoa atau kemampuannya untuk memindahkan ikatan ligand dihalangi
(missal penambahan inhibitor), maka ikatan ZP tidak akan didegradasi. ZBP
akan kembali jenuh dengan reseptor dan penetrasi tidak terjadi. Hipotesis ini
dapat menjelaskan kekhasan spesies dalam penetrasi zona.
5. Penggabungan Spermatozoa dengan Zona.
Selama menembus zona pelusida, kepala spermatozoa menerobos ruang
vitellin, menuju ke vitelus dan secara bertahap bergabung ke dalamnya. Proses
dinamis ini dapat diamati secara kontinyu pada kondisi in vitro secara cermat.
Pada binatang berkantung, Burung dan hewan laut juga invertebrata laut
fusi sel telur dengan spermatozoa dimulai antara membran akrosom bagian
dalam dan membran plasma telur. Keadaan yang berbeda terjadi pada mammalia, yaitu pada membran plasma spermatozoa tidak pada membran akrosom
bagian dalam yang bergabung pertama kali dengan membran plasma telur. Ini
pertama kali ditemukan pada tikus. Pemasukan kepala spermatozoa ke dalam
sel telur diikuti oleh penggabungan secara bertahap ekor spermatozoa secara
keseluruhan.
. TEMPAT-TEMPAT INISIASI FUSI SPERMATOZOA DAN
TELUR
Mula-mula disebutkan fusi dimulai pada membran plasma spermatozoa
bagian post akrosom. Akan tetapi bila diamati secara cermat aksi penggabungan
terletak pada segmen equator. Hal ini bisa terjadi sesudah spermatozoa mengalami
reaksi akrosom. Bila spermatozoa telah kapasitasi sempurna tetapi tidak reaksi
maka tidak dapat bergabung dengan sel telur. Perubahan isiologis yang penting
yang harus terjadi pada membran plasma segmen equatorial sebagai hasil dari
reaksi akrosom, walaupun terjadi pada membran masih belum jelas.
Permukaan telur memiliki sejumlah mikrovili, kecuali daerah di atas
spindle sesudah pembelahan meiosis ke dua. Daerah bebas mikrovilli kaya akan
aktin yang terpolarisasi. Fusi antara spermatozoa dengan sel telur tidak akan
atau jarang terjadi pada daerah yang gundul ini. Meskipun spermatozoa menuju
ke kelompok mikrovilli, tetapi banyak peneliti yang beranggapan bahwa yang
berperanan pada fusi yaitu daerah intermicrovilli, karena membran plasma microvilli bukan diperuntukkan untuk fusi antara spermatozoa dengan sel telur.
5.5. KEJADIAN-KEJADIAN SESUDAH FUSI
Sel telur sesudah dipenetrasi oleh spermatozoa secara metabolis bangkit
untuk serangkaian peristiwa morfologi dan biokimia yang mengarah ke deferensiasi dan formasi individu baru, pembangkitan dianggap sebagai aktivitas.
Indikasi yang mudah dikenal dalam aktivasi sel telur pada mammalia yaitu
exocytosis granula-granula cortical dan rangkaian meiosis. Nukleus sel telur yang
sesudah metatahap II istirahat, maka mulai meiosis lagi sesudah fusi antara sel telur
dan spermatozoa. Nukleus haploid mentransformasi ke dalam pronukleus sel
telur. Sementara nukleus spermatozoa merata dan mentransformasi ke dalam
pronucleus spermatozoa. Sintesa DNA (duplikasi akrosom) terjadi sesudah penggabungan kedua pronukleus. Pembungkus intinya meluruh dan akrosomnya
bercampur.
Untuk pembelahan meiosis pertama, pencampuran kromosom dapat
dianggap sebagai akhir fertilisasi dan awal perkembangan embrio. Pada beberapa
invertebrata dan vertebrata non mammalia, interval antara fusi spermatozoa
dengan telur dan inisiasi pembelahan pertama yaitu dalam beberapa jam,
sedang mammalia biasanya memerlukan 12 jam atau lebih.
AKTIFITAS SEL TELUR
Fisiologi dan biokimia aktivasi telur telah diteliti secara luas pada mammalia dan invertebrata terutama sea-urchin. Namun aktivasi ini belum
diketahui secara menyeluruh. Fusi spermatozoa dan sel telur memicu
pelepasan ion Ca2+ dari intra selluler (Misalnya retikulum indoplasma). Ca2+
intra selluler meningkatkan masuknya Na+/H+
yang memicu pH intra
selluler meningkat temporer. Peningkatan pH temporer ini tampaknya menutup protein penghambat dalam sitoplasma sel telur yang menghasilkan aktivasi
irreversible jalur oksidatif telur, metabolisme lipid, reduksinucotinamide serta
sintesis protein DNA.
Sangat sedikit diketahui tentang mekanisme aktivasi sel telur pada mammalia. Pada sel telur Hamster, pelepasan secara eksplosif Ca2+ terjadi 10 – 30
detik sesudah penetrasi spermatozoa ke dalam membran plasma sel telur. Yang
menarik, ledakan atau keluarnya Ca2+ terjadi secara berulang dengan interval
sekitar 3 menit selama 100 menit. Signiicansi biologis pelepasan Ca
2+ berulang
tidak diketahui, tetapi dapat dihubungkan dengan beberapa aktivitas sistim
cytoskeleton, sebagai contoh depolimerisasi dan polimerisasi tubulin.
Komponen sel telur termasuk membran plasma telur berubah karakter
biologis dan biokimianya sesudah terjadi aktivasi telur. Contohnya permeabilitas
membran plasma sel telur tikus terhadap gliserol meningkat secara dramatis
dalam waktu 3 jam sesudah fertilisasi/aktivasi sel telur.
Sejumlah chanel voltage-gated Ca2+ dalam membran plasma telur meningkat
secara nyata selama satu jam pertama diikuti dengan aktivasi sel telur. Fertilisasi
atau aktivasi telur memiliki sedikit pengaruh terhadap permeabilitas membran
plasma sel telur tikus. Juga mobilitas molekul-molekul lipid dalam membran
plasma membran sel telur tidak berubah secara nyata selama aktivasi sel telur.
Sel telur mammalia dapat diaktivasi oleh variasi rangsangan isik dan
kimia. Semua rangsangan pengaktifan ini tampak memicu peningkatan
konsentrasi Ca2+ intraselluler. Kebanyakan rangsangan ini tampak menginisiasi
beberapa respons pada level membran plasma sel telur. Tak seorangpun tahu
secara tepat bagaimana spermatozoa memulai aktivasi sel telur. Spermatozoa
membawa substansi pengaktifasi telur yang spesiik ke dalam sel telur sudah
lama diketahui, akan tetapi juga diketahui bahwa pada serangga, ikan dan kadal
diketahui sel-sel telur dapat teraktivasi tanpa adanya spermatozoa, mereka telah
memproduksi generasinya secara parthenogenesis untuk mendapatkan keturunannya. Meskipun sel telur mammalia secara potensial mampu menginisiasi
perkembangan tanpa spermatozoa, maka tidak berarti bahwa spermatozoa tidak
memiliki fungsi dalam aktivasi sel telur, sebab pada kondisi yang normal,
spermatozoa yang mengaktivasi sel telur. Pada landak laut dan tikus penyuntikan
Ca2+ ke dalam sitoplasma sel telur akan mengaktivasi sel telur secara eisien,
akan tetapi kita masih belum bisa secara pasti mengatakan pengaktifasi sel telur
yaitu ion Ca2+ masih membutuhkan pendukung yang lebih kuat.
Lamina tebal post acrosome domba sangat kaya kalsium, dapat dibayangkan
bahwa ion Ca2+ yang dilepaskan dari lamina sesudah fusi spermatozoa dengan
sel telur memicu aktivasi sel telur. Inositol triphosphattase yang diinjeksikan
secara microsurgical ke dalam sel telur landak laut akan mengaktivasi sel telur
dengan sangat eisien.
EXOCYTOSIS GRANULA-GRANULA CORTICAL DAN
HAMBATAN POLYSPERMA
Granula-granula kecil yang berbentuk bola pada membran pembatas
organel ditemukan di bawah membran plasma sel telur masak yang tidak
dibuahi, hal ini banyak dijumpai pada kebanyakan vertebrata dan kebanyakan
invertebrata. Dengan memakai mikroskop tahap kontras ditemukan adanya
granula-granula ini juga pada mammalia. Banyak granula kecil pada bagian
korteks telur hamster yang tidak dibuahi dan akan hilang selama fertilisasi, dengan demikian dapat disimpulkan bahwa granula-granula ini homolog dengan
granula-granula cortical landak laut yang berperan dalam modiikasi penutup
sel telur selama fertilisasi.
Pada landak laut dan ikan, eksositosis dimulai pada dekat titik fusi spermatozoa dan akan segera menyebar dalam bentuk seperti gelombang ketempat
yang berlawanan pada sel telur. Gelombang eksositosis granula cortical landak
laut ini didahului oleh gelombang intraselluler Ca2+ yang dilepaskan. Eksositosis
granula cortical yaitu suatu proses yang tergantung pada Ca2+. Pada hamster
pelepasan Ca2+ intraselluler mulai dekat fusi spermatozoa sel telur, tetapi gelombang seperti penyebaran exocytosis granula cortical belum dapat dibuktikan.
Granula cortical sel telur mammalia mengandung enzim-enzim hidrolitik
dan komponen-komponen sakarida. Pada beberapa spesies kandungan granula
cortical yang dilepaskan dari korteks sel telur selama fertilisasi atau aktivasi
sel telur akan merubah karakteristik isik dan kimia zona pellusida, sehingga
zona dapat dipenetrasi oleh spermatozoa, ini yang disebut dengan reaksi zona.
Reaksi zona yaitu hidrolisis (inaksivasi) glikoprotein zona oleh proteinase
atau glikosidase yang dilepaskan oleh germinal cortical selama aksositosis. Spermatozoa bertanggung jawab pada penyerangan yang kuat terhadap zona,
sehingga spermatozoa mengalami hidrolisis dan zona tidak dapat menangkap
spermatozoa dengan kuat. Reaksi akrosom yang memiliki kemampuan untuk
menginduksi zona juga dihilangkan, akibatnya spermatozoa tidak mampu lagi
menembus zona.
Germinal cortical juga untuk menghambat polyspermi. Membran plasma
telur juga memiliki kemampuan untuk membuang kelebihan spermatozoa.
Penghambatan polyspermi ini pada level membran plasma disebut dengan
Vittelline Block atau egg plasma membrane block. Sayangnya sifat dan mekanisme vitteline block ini masih sedikit diketahui, meskipun beberapa peneliti telah
menyebutkan kemungkinan keterlibatan material germinal cortical dalam pembentukan vitteline block masih belum ada bukti yang kuat untuk mendukung
pernyataan ini. Pada landak laut, membran plasma sel telur menolak kelebihan
spermatozoa dalam beberapa detik sesudah penyerangan spermatozoa yang
pertama. Panghambatan yang cepat terhadap polyspermi ini bersifat elektrik.
Peningkatan potensial membran yang tiba-tiba dipicu oleh fusi antara
spermatozoa dengan sel telur, hal ini mencegah terjadinya fusi yang berlebihan
dari spermatozoa. Sampai saat ini belum ada bukti yang kuat bahwa vitteline block
pada mammalia dicapai oleh mekanisme elektrik yang sama.
Eisiensi reaksi zona dan vitteline block dapat disimpulkan dengan mempelajari sejumlah spermatozoa yang memasuki ruang perivittelin dan sitoplasma
sel telur yang diikuti perkawinan alami atau Inseminasi Buatan. Dengan cara ini
telur-telur hamster, anjing, domba diketahui mengalami reaksi zona yang
sangat kuat. Sedangkan telur-telur kelinci dan tikus sebaliknya, yaitu tidak tampak
mengalami reaksi zona atau hanya reaksi lemah pada kondisi alami. Telur-telur
ini hampir sepenuhnya tergantung dari vittelin Block untuk menghindari
polyspermy. Sel-sel telur tikus besar, mencit, marmut, kucing secara in vitro sama
dengan manusia yaitu mengalami reaksi zona yang kuat, bahkan ketika diinseminasikan dengan sejumlah spermatozoa, maka sebagian besar spermatozoa
mengikat permukaan zona lebih dari jumlah yang biasa pada bagian dalam zona.
Sangat mungkin zona bagian dalam merupakan tempat reaksi zona, sehingga
fertilisasi polispermi bisa terjadi. Salah satu sebab yang mungkin polyspermi
pada manusia yaitu penundaan eksocytosis germinal cortical dan memicu penundaan terjadinya reaksi zona. Kerusakan zona bertanggung jawab
terhadap ketidak eisienan atau bagian penghambat terhadap polyspermi pada
level zona.
Sel telur tikus mensekresikan suatu faktor yang disebut dengan ovum
faktor yang secara langsung atau tidak langsung merangsang produksi progesterone induk. Ovum faktor bukan merupakan ovum tunggal, dia dalam bentuk
molekul ganda. Ovum faktor pertama kali dilepaskan sel telur pada saat fertilisasi
(aktivasi parthenogenesis) dan terus diproduksi sedikitnya pada tahap blastosit.
Sehingga diduga ovum faktor yaitu komponen germinal cortical yang dikeluarkan. Ovum faktor juga terus dikeluarkan oleh embrio selama perkembangan
preimplantasi, sehingga diduga ovum faktor tidak saja merupakan komponen
germinal kortical tetapi yang lainnya.
Exositosis germinal kortical juga terjadi saat fertilisasi, akan tetapi jumlahnya lebih banyak dikeluarkan selama telur berada di ovarium.
Exocytosis germinal cortical premature memiliki dua fungsi:
1. Dapat mendukung pembentukan perivitellin. Sangat mungkin bahwa preksistensi ruang perivittelin membentau sperma telur pada mammalia. Jika
ruang perrivittelin tidak ada sebelum fertilisasi, ujung akrosom spermatozoa tereaksi yang telah menembus zona menjadi lengket pada permukaan
kortek telur. Dengan dicegah dari kemajuan lebih lanjut, spermatozoa
tidak akan fusi membran plasma telur karena membran akrosom bagian
dalam yang menutup bagian depan akrosom spermatozoa tereaksi bersifat
nonfusigenik. Sebaliknya jika ruang vittelin ada kepala spermatozoa yang
telah menembus zona dapat bergerak bebas. Membran plasma sperma
fusigenik pada equatorial akrosom bisa bergabung dengan membran plasma
telur tanpa kesulitan.
2. Exositosis premature sedikit merubah karakteristik isik dan kimia zona
pellusida dan membran plasma telur dengan cara sedemikian rupa sehingga
hanya spermatozoa yang motil dan sangat kuat yang dapat melakukan penetrasi telur. Ini beralasan untuk berpendapat bahwa exositosis CG premature selama fertilisasi dan pemecahan pada exositosis CG selama fertilisasi
bekerja secara sinergis dalam melindungi telur dari bahaya polispermi atau
fertilisasi oleh spermatozoa yang lemah.
DEKONDENSASI NUKLEUS SPERMATOZOA DALAM SITOPLASMA TELUR
Pada tahap akhir ketika berlangsungnya pemadatan nucleus sperma,
hampir semua histon somatic di dalam sperma dipindahkan oleh sekelompok
tertentu histon atau protemine-protemine yang kaya akan arginine, serine
cysteine. Diyakini bahwa, kekompleksan DNA spermatozoa terhadap muatan
asam amino merupakan dasar yang memungkinkan kromatin beraktiitas.
Salah satu gambaran tunggal tentang nucleus spermatozoa mammalia
yaitu rantai silang SS ekstensif protamine-protamine inti yang terjadi selama
spermatozoa di epididimis. Hasilnya, nucleus spermatozoa yang sudah masak memiliki kekuatan yang elastis. Hal ini menguntungkan untuk aliran
spermatozoa secara mekanik melalui zona pellusida yang tebal dan agak ulet.
Rantai silang yang berlebihan akan menyulitkan nukleus untuk mengkondensasi
kedalam sitoplasma telur. Pada manusia Zn2+ yang berasal dari prostat dapat
bertindak dalam pencegahan pembentukan rantai silang SS yang berlebihan dari
protein/protamin yang terjadi selama kapasitasi spermatozoa.
Salah satu kejadian ketika nucleus bergabung kedalam sitoplasma telur
yaitu disintegrasi yang cepat menutup inti. Kromatin spermatozoa secara
langsung membuka sitoplasma telur. Ini memungkinkan faktor-faktor dalam
sitoplasma telur untuk mencapai jalan masuk ke kromatin dan dengan demikian
merubah komposisinya. Sifat dari faktor-faktor inilah yang bertanggung jawab
terhadap disintegrasi telur secara cepat pada telur sesudah dibuahi.
Sekali penutup sel telur disintegrasi, kromatin spermatozoa mulai kehilangan protamin-protamin dengan cepat, bahwa sebelum dekondensasi kromatin
terbukti. Meskipun protein-protein dasar yang baru disintesis akan menggantikan protamin-protamin pada suatu periode tertentu (Misalnya selama tahap
akhir dekondensasi kromatin). Ketika kromatin spermatozoa tanpa protamin dan
histon-histon somatic. Jika ini benar ia mewakili kondisi tunggal, sebab seperti
pada pembelahan sel secara cepat, histon-histon disimpan dengan cepat dalam
DNA. Sintesa DNA mulai sesudah perpindahan protamin dan dekondensasi
kromatin selesai.
Nukleus spermatozoa mammalia didekondensasi oleh duhiothreito
(DDT) dan sodium dodecyl sulfat, banyak senyawa tambahan ditunjukkan untuk dekondensasi nucleus spermatozoa dengan cara yang kurang lebih sama.
Dekondensasi didalam sel telur (secara in vitro) nucleus spermatozoa dibantu
oleh reduksi SS protein inti. Reasgen yang keras seperti DDT dapat menjadi
faktor dekondensasi inti alami dalam bentuk reduksi glutathionine (GSH). Kenyataannya reduksi buatan GSH didalam sel telur (dengan menghambat GSH
sinhetahap ) memicu sel telur tak mampu mengkonsendasi sel spermatozoa.
Bagaimanapun juga GSH tidak dapat menjadi satu-satunya faktor yang bertanggung jawab pada dekondensasi inti secara in vitro, karena sitoplasma telur
hamster yang tidak masak (pada tahap germinal vesikel) dan telur hamster yang
masak sepenuhnya kaya akan GSH, namun yang pertama tidak sama dengan
yang berikutnya yaitu tidak mampu mengkondensasi nucleus spermatozoa.
Karena nucleus-nukleus spermatozoa hamster yang diperlakukan dengan
DDT dapat mengkondensasi dalam sitoplasma telur yang tidak masak pada tahap germinal vesicle dapat dibayangkan bahwa (a) Sesuatu di dalam sitoplasma
telur yang tidak masak menghalangi GSH dari aksi protein ini. (b) Sesuatu selain
GSH hilang dari sitoplasma. Nukleus-nukleus katak, tikus dan hamster tidak
dikondensasi sama sekali atau mereka hanya dikondensasi sangat kecil tanpa
keberadaan bahan germinal vesicle (GV) dalam sitoplasma telur. Material GV
(atau beberapa produk interaksinya dengan komponen sitoplasma sel telur)
harus memindah/menutup beberapa faktor penghalang yang diperlukan untuk
suatu kondensasi nucleus spermatozoa yang eisien. Kemungkinan lain faktor
dekondensasi nucleus spermatozoa secara bertahap diakumulasikan ke dalam
sitoplasma pertumbuhan telur dan diaktifasi oleh material GV sesudah pemecahan GV. Penting untuk dicatat bahwa sitoplasma untuk binatang lain (Misal :
anjing, Ikan, Moluska) dapat mengkondensasi nucleus spermatozoa sebelum
pemecahan GV atau ketika pemecahan GV dihambat pada kondisi eksperimen.
Tampaknya pada telur-telur binatang ini faktor dekondensasi sperma aktif atau
menjadi aktif sebelum material GV bercampur dengan sitoplasma telur. Ini
yaitu suatu pemikiran bahwa suatu proteinase yang bergabung dalam nucleus
spermatozoa terlibat dalam dekondensasi inti spermatozoa, tetapi riset
selanjutnya belum mampu mendukung riset ini .. Namun demikian
keterlibatan secara langsung atau tidak langsung proteinase-proteinase dalam
sitoplasma sel telur masih merupakan suatu kemungkinan. Sel Telur Hamster
yang tidak dibuahi memiliki amino peptidase dan aktiitas-aktiitas seperti
elastase. Apakah aktiitas-aktiitas enzim sedemikian berperan dalam dekonden-
sasi nucleus plasma tinggal ditentukan. Gulationine reduktase dan protein kinase
ada pada sel telur yang dihomogenisasi. Beberapa peneliti berpendapat
(a) Phosphorilase antara protein kinase, protamine inti spermatozoa membantu
melepaskan protamine-protamine dari DNA (b) GSH yang diproduksi dan
dipertahankan oleh gluthationine reduksi ikatan SS molekul-molekul protamine
yang dilepaskan.
Metode standard untuk evaluasi fertilitas pejantan yaitu kemampuan
membuntingi yang dapat diprediksikan dengan memastikan kualitas semennya.
menyatakan Tidak ada satu uji kualitas pun yang dapat
memprediksi fertilitas secara akurat. Pedoman berdasar pada persatuan theriogenology minimal dari karakteristik kualitas semen pada pejantan yang dipergunakan untuk breeding pada sapi dengan klasiikasi:
1. spermatozoa lebih dari 500 juta/ml Jumlah
2. Lebih dari 50% bergerak progressif
3. Lebih dari 80% memiliki morfologi normal
Ternak dinyatakan steril kalau tidak ada spermatozoa yang motil.
Analisa diagnostik yang menunjukkan fungsi testis dan epididimis yang diperiksa
beberapa kali dan minimum disebut fertil bila sampel semennya:
1. Motilitas tidak kurang dari 65%
2. spermatozoa abnormal Kurang dari 20% morfologi