okteran militer karena sel darah merah
yang disimpan dengan cara ini memiliki waktu simpan yang lama. Penyimpanan ini juga
mempermudah penyimpanan darah dari golongan-golongan darah yang jarang diperlukan
oleh pasien dengan masalah antibodi yang sulit. Banyak unit transfusi darah yang mendorong
pasien dengan antibodi kompleks terhadap antigen tertentu untuk menyimpan sel darah
merah sendiri jika diperlukan di masa mendatang.
3) Sel darah merah Cuci (Washed Red Cell)
Washed red cell diperoleh dengan mencuci packed red cell 2-3 kali dengan saline (Nacl
0,9%), dan kemudian sisa plasma terbuang habis. sebab proses pencucian berlangsung
dengan sistem terbuka, produk harus dipakai dalam waktu 24 jam. Mencuci sel darah
merah menghilangkan protein plasma, beberapa leukosit,dan sisa trombosit. Produk ini
ditunjukkanuntuk pasien yang telah mengalami alergiberat akibat transfusi berulang dan
reaksi yang tidak bisa dicegah oleh antihistamin. Berguna untuk penderita yang tidak bisa
diberi komponen plasma, diantaranya dipakai dalam pengobatan aquired hemolytic anemia
dan exchange transfusion. Kelemahan washed red cell yaitu bahaya infeksi sekunder yang
terjadi selama proses serta masa simpan yang pendek (4-6 jam).
Gambar Kantong pencucian sel darah Merah (washing bag PRC)
Pencucian PRC dibagi dua cara , yaitu :
a) Cara manual :
- Menggunakan kantong cuci ( washingbag )
- Tambahkan NaCl 0.9 % ke dalam kantong darah yang akan dicuci sampai penuh ,
melalui slang 1
- Putar 1500 xG 30 menit atau 4850 xG 4°C 3 menit
- Buang supernatan melalui slang 2
- Ulangi prosedur sampai 3 kali melalui slang 3 , 4, dst
- Tinggalkan supernatan sampaiHt 70 %
b) Dengan mesin :
- masukkan PRC kedalam mangkok khusus
- putar
- alirkan NaCl 0.9 % secara terus menerus.
- supernatan dibuang secara kontinyu.
- PRC yang telah dicuci dipindahkan ke dalam kantong darah dengan Ht 70 %.
4) Leukosit Pekat (Buffy Coat)
Isi utama leukosit pekat (Buffy Coat)adalah granulosit. Leukosit pekat disiapkan dalam
bentuk buffy coatdengan volume berkisar antara 50-80 mL. Temperature simpan berkisar
antara 20±2o C, sedangkan lama simpan harus segera ditransfusikan dalam 24 jam. Leukosit
pekat berguna untuk meningkatkan jumlah granulosit. Pelayanan pre transfusi adalah
melalui uji cocok serasi darah donor dan pasien. Efek samping yang ditimbulkan urtikaria,
mengigil, demam.
Gambar . leukosit pekat(buffy coat)
Saat ini leukosit pekat(buffy coat) jarang dipakai , data yang menunjukkan pemakaian
transfusi leukosit pekatpada pasien dewasa septic granulositopenik kurang memuaskan,
tetapi granulosit buffy coat yang dikumpulkan dari satu atau dua unit darah segar mungkin
bermanfaat dalam penatalaksanaan sepsis pada bayi baru lahir. Cairan granulosit buffy
coatini adalah suspensi granulosit dalam plasma yang dibuat dengan sitaferesis, yang lebih
tepat disebut granulosit feresis (granulositoferesis). Komponen ini, sebaiknya mengndung
minimal 1x1010 granulosit. Granulositoferesis menghasilkan sekitar 1x1010 granulosit dalam
300 mL sampai 500 mL plasma, sekitar 25 mL sel darah merah pasti akan mencemari produk
granulosit dan juga ada trombosit dalam jumlah yang bermakna. Transfusi granulosit
jarang menjadi regimen pengobatan untuk leukemia, tetapi pemakaian optimal masih
diperdebatkan dan transfusi komponen darah ini seharusnya diberikan hanya dengan
protokol yang sesuai.
5) Konsentrat Trombosit (Thrombocyte Concentrate)
Isi utama trombosit pekat adalah trombosit dengan volume sekitar 50 mL, temperatur
simpan berkisar antara 20±2 oC dan lama simpan 3 hari tanpa goyangan dan 5 hari dengan
goyangan. Trombosit pekat berguna untuk meningkatkan jumlah trombosit pasien.
Peningkatan post transfusi pada dewasa, rata-rata 5000-10000/ µL. Efek samping yang
mungkin timbul setelah transfusi trombosit pekat: urtikaria, menggigil, demam, aloimunisasi
antigen trombosit donor.
Saat ini tersedia dua jenis konsentrat trombosit donor yaitu:
1. Konsentrat trombosit unit tunggal yang disebut trombosit dari darah lengkap yang
mengandung trombosit lebih dari 5,5x1010 yang tersuspensikan dalam sejumlah kecil
plasma.
2. Konsentrat tromboferesis (platelet pheresis consentrates) disisapkan dari sitaferesis,
mengandung minimal 3x1011 Trombosit (trombosit, feresis). Konsentrat tromboferesis
dari satu donor darah mengandung eqivalen 6-8 unit trombosit yang berasal dari 6-8
donor acak darah lengkap. Prosedur hemaferesis memungkinkan kita memproses
sejumlah besar darah dari satu donor darah karena sel darah merah dan elemen lain
segera dikembalikan ke donor. Sejumlah besar plasma, trombosit atau sel darah putih
juga dapat diolah dengan teknik ini. Konsentrasi tromboferesis berasal dari satu donor
sehingga mengurangi pajanan donor dibandingkan dengan konsentrat yang dikumpulkan
secara acak dan berasal dari darah lengkap. Akibatnya, risiko imunisasi atau infeksi tekait
transfusi berkurang.
Gambar (a) Konsentrat trombosit secara manual , (b) Konsentrat trombosit secara
aferesis (tromboferesis)
Trombosit dapat disimpan sampai 5 hari pada temperatur 22± 2oC pada agitator
trombosit untuk mencegah penggumpalan tombosit. Masa hidup trombosit yang lebih
singkat daripada sel darah merah, dimana trombosit bertahan hidup hanya 8 sampai 10 hari
secara invivo, sedangkan eritrositmasa hidupnya sampai 120 hari. Kelangsungan hidup
trombosit secara in vitro bahkan lebih singkat. Trombosit memiliki waktu simpan maksimum
5 hari, tetapi kelangsungan hidup dan efektifitas pascatransfusi sangat menurun selama
penyimpanan.
Efek terapeutik konsentrat trombosit, rata-rata satu unit konsentrasi trombosit
mengandung 5,5 x 1010 trombosit. Walaupun angka spesifik sangat bervariasi, halini
merupakan angka rata-rata realistik yang dipengaruhi oleh teknik pemilihan donor,
flebotomi, persiapan, penyimpanan, dan pengangkutan yang benar. Pada pasien yang stabil
secara hematologis, transfusi satu unit trombosit meningkatkan jumlah trombosit sekitar
5000-10000 permikroliter per meter persegi luas permukaantubuh. Peningkatan pasca
transfusi biasanya diukur pada satu jam dan 24 jam setelah transfusi. Indikasi utama terapi
trombosit adalah untuk pasien dengan trombositopenia simptomatik. Trombositopenia
memiliki banyak mekanisme, dan transfusi trombosit paling efektif jika terjadi gangguan
pembentukan trombosit, seperti yang terjadi pada aplasia sumsum tulang (misalnya
pascakemoterapi, atau pada kegagalan sumsum tulang). Selain itu trans fusi trombosit
diberikan pada pasien trombositopenia yang berkaitan dengan destruksi sekunder atau
sekuestrasi perifer. Apabila trombosit diberikan kepada pasien yang sedang mengalami
pendarahan dan rendahnya jumlah trombosit, trombosit yang ditransfusikan akan
mengalami destruksi serupa dengan yang dialami trombosit pasien. Pada kasus-kasus ini,
transfusi trombosit hanya memicu sedikit perbaikan klinis. Pasien dengan limpa yang
besar atau dengan destruksi trombosit akibat autoimun tidak banyak memperoleh manfaat
dari transfusi trombosit. Infeksi atau demam tinggioleh sebab apapun juga mempercepat
kelangsungan hidup trombosit yang ditransfusikan. Bagaimanapun, evaluasi peningkatan
trombosit setelah transfusi, terutama 1 jam dan 24 jam, sangat bermanfaat dalam
menentukan kelangsungan hidup trombosit in vivo. Hal ini penting secara klinis dalam
penilaian apakan orang yang mendapat transfusi trombosit mengalami aloimunisasi
terhadap trombosit ini dan juga dalam menentukan dan mendefinisikan terapi
trombosit yang paling efektif.
6) Liquid Plasma (LP)
Isi utama liquid plasma adalah plasma yang mengandung faktor pembekuan stabil dan
protein plasma, volume pada kantong darah 150 – 220 ml . Suhu simpan pada 4°±2° C sampai
dengan 5 hari setelah tanggal kadaluarsa darah lengkap asal. Penggunaan liquid plasma
bertujuan untuk :
a) Meningkatkan volume plasma , tetapi pemakaian cairan pengganti lebih dianjurkan.
b) Meningkatkan faktor pembekuan stabil [ Faktor II , VII , IX , X , XI ]
Gambar . Liquid Plasma (LP)
Pelayanan liquid plasma dengan cara mencocokan ABO dan Rhesus donor dengan
eritrosit pasien. Efek samping yang ditimbulkan, antara lain : urtikaria , menggigil , demam ,
hipervolemia. Waktu pemisahan dari darah lengkap kapan saja sampai 5 hari setelah tanggal
kadaluarsa darah lengkap asal. Metoda pemisahan bisa dialkukan dengan metode
plasmaferesis dan juga pemutaran darah lengkap/ whole blood.
7) Plasma Segar Beku (Fresh Frozen Plasma)
Isi utama FFP adalah plasma dan faktor pembekuan labil. Volume FFP berkisar antara
150 sampai 220 mL. Temperatur simpan FFP adalah -18 oC atau lebih rendah. Lama simpan
satu tahun. FFP berguna untuk meningkatkan faktor pembekuan labil apabila faktor
pembekuan pekat/kriopresipitat tidak ada. Pelayanan untuk FFP adalah cocok untuk golongan
darah ABO dengan erirosit pasien. Ditransfusikan dalam waktu 6 jam setelah dicairkan. Ffp
berguna untuk meningkatkan faktor pembekuan. Efek samping pemberian FFP adalah
urtikaria, mengigil, demam, hipervolemia. FFP merupakan bagian cair dari unit darah lengkap
yang diambil dan dibekukan dalam 6 sampai 8 jam dan disimpan pada temperature -18oC.
sebab diproses sedemikian cepat, plasma beku segar juga mengandung faktor koagulasi labil
(VIII,V), semua faktor pembekuan lainnya, dan protein plasma.
Gambar . Fresh Frozen Plasma (FFP)
Indikasi utama pemakaian plasma beku segar adalah pada defisiensi faktor pembekuan
dengan gangguan hemostatik di mana masih belum diketahui faktor pembekuan apa yang
menjadi penyebab atau terjadi defisiensi multiple. Plasma beku segar seyogyanya jarang,
kalaupun pernah, diberikan untuk ekspansi volume. Namun, larutan ini dapat secara
memuaskan dipakai untuk rekonstruksi sel darah merah untuk transfusi tukar pada bayi
baru lahir.
Plasma yang dibekukan dalam 24 jam setelah pengmbilan dan plasma yang kurang
mengandung kriopresipitat adalah produk sampingan persiapan komponen dan sering lebih
murah daripada FFP. Kadar faktor-faktor koagulasi yang labil lebih bervariasi daripada FFP,
tetapi produk ini memiliki kadar faktor koagulasi stabil, albumin, zat bakterisidal, opsonin dan
konstituen lain yang sama dengan FFP. FFP yang kurang mengandung kriopresipitat
merupakan komponen pilihan yang dipakai untuk pengobatan Purpura Trombositopenik
Trombotik (PTT) karena tidak mengandung multimer faktor willebrand yang diperkirakan
penting dalam pathogenesis PTT dan berisi aktivitas protease pemecah vWF.3
8) Kriopresipitat (Cryoprecipitate)
Isi utama kripresipitat adalah faktor pembekuan VIII, faktor pembekuan XIII, faktor von
willebrand dan fibrinogen. Temperature simpan -18oC atau lebih rendah dan lama simpan
selama 1 tahun. Kriopresipitat berguna untuk meningkatkan faktor pembekuan VIII, faktor
pembekuan XIII, faktor von Willebrand (vWF) dan fibrinogen. Pelayanan kriopresipitat dengan
mencocokkan golongan ABO dengan eritrosit pasien dan harus ditansfusikan dalam waktu 6
jam setelah dicairkan. Efek samping setelah pemberian kriopresipitat adalah demam dan
alergi. Kriopresipitat merupakan bagian plasma yang dingin dan tidak larut yang diproses dari
FFP. Kriopresipitat adalah residu gelatinosa yang diperoleh dengan membekukan dan
mencairkan secara lambat plasma yang baru diambil. Kriopresipitat mengandung 80 sampai
100 IU faktor VII, vWF dan sekitar 250 mg fibrinogen (minimum 150 mg) dalam volume 10-15
mL/unit.3
Gambar Kriopresipitat
Kriopresipitat bermanfaat untuk mengobati pendarahan ringan sampai sedang pada
pasien dengan penyakit von wiillebrand. Apabila diperlukan konsentrasi vWF yang sangat
tinggi, seperti pada perdarahan yang mengancam nyawa atau untuk prosedur bedah, lebih
baik dipakai beberapa konsentrat komersial yang mengandung vWF. Plasma beku segar
dan kriopresipitat juga merupakan sumber terbaik untuk vWF, yang tinggi ada di banyak
konsentrat faktor VIII komersial. Kriopresipitat juga bermanfaat dalam manajemen keadaan
hipofibrinogemia dan pada koagulasi intravascular diseminat dengan konsumsi fibrinogen.
Kriopresipitat juga dapat dikenai prosedur-prosedur inaktivasi virus seperti pemanasan dan
pemberian pelarut deterjen. Kecenderungan yang sekarang meningkat adalah pemakaian
kriopresipitat untuk menyediakan fibrinogen, yang kemudian dapat diaktifkan menjadi fibrin
oleh thrombin di tempat pendarahan selama pembedahan. “Lem Fibrin” ini sekarang menjadi
praktek standar di banyak prosedur bedah vascular.3
9) Konsentrat faktor VIII
Komponen ini adalah suatu konsentrat liofilisasi plasma yang berasal dari 30000 donor,
yang terutama mengandung faktor VIII, tetapi juga sejumlah kecil fibrinogen dan protein lain.
Tersedia preparat dengan kemurnian sedang, kemurnian tinggi dan kemurnian sangat tinggi
yang sesuai dengan metode pemurniannya. Sebagian besar prosedur pemurnian antibody
monoclonal (afinitas) menghasilkan konsentrasi yang kemurniannya sangat tinggi dengan
hanya sedikit protein pencemar. Kandungan faktor VIII spesifik (unit aktifitas faktor VIII per
mg protein berbeda-beda dan hal ini dicantumkan di setiap vialnya. Rentang aktifitas faktor
VIII total biasanya adalah 800 sampai 1600 IU/mg. Molekul faktor VIII telah berhasil diklon dan
juga tersedia sebagai protein rekombinan. Preparat ini lebih mahal daripada konsentrat yang
berasal dari plasma, tetapi memiliki keunggulan karena tidak menularkan penyakit infeksi
terkait plasma. Namun peparat ini masih mungkin bersifat imunogenik dan memicu respon
imun, termasuk aloimunisasi (inhibitor faktor VIII).
10) Konsentrat Faktor IX
Komponen ini mengandung konsentrat faktor-faktor dependen vitamin K, yaitu faktor
II,VII, IX dan X yang berasal dari kumpulan ribuan donor. Dengan demikian, komponen ini
memiliki faktor resiko serupa dengan konsentrat faktor VIII, namun konsentrat ini dibuat
dengan fraksionisasi plasma bukan kriopresipitasi. Produk-produk ini merupakan terapi
pilihan untuk perdarahan atau profilaxispada pasien penyakit Critsmas (defisiensi faktor IX).
Indikasi lain adalah defisiensi congenital faktor protrombin, VII dan X. Pengolahan komponen
ini juga dilakukan dengan pemanasan dan atau pelarut detergen, seperti faktor VIII. Beberapa
konsentrat faktor IX juga mengandung sejumlah kecil faktor koagulasi aktif sehingga dapat
berguna dalam penanganan pasien hemophilia dengan inhibitor terhadap faktor VIII. Sekarang
juga tersedia konsentrat faktor IX rekombinan.3
11) Preparat Globulin serum dan Inhibitor Protease Plasma
Fraksionase plasma komersial juga dapat memekatkan gamaglobulin untuk diberikan
kepada pasien dengan defisiensi antibody humoral yang parah. Kumpulan plasma yang
mengandung gamaglobulin spesifik dengan titer tinggi dapat dipakai sebagai preparat
serum gamaglobulin hiperimun untuk penanganan pasien yang pernah terpajan ke globulin
imun-varisela-zoster (VZIG) atau serum imun hepatitis B. Plasma normal juga mengandung
inhibitor-inhibitor alamiah terhadap protein yang diaktifkan selama proses fisiologik, seperti
thrombin pada koagulasi, tripsin pada pencernaan protein, atau C1 esterase pada pengaktifan
komplemen. Beberapa inhibitor alamiah ini juga dipekatkan selama fraksionasi plasma untuk
dipakai dalam terapi keadaan-keadaan defisiensi congenital dan didapat (misalnya,
trombofolia defisien-antitrombin, defisiensi alfa 1-antitripsin (enfisema) dan defisiensi C1-
esterase (edema angio-neurotik).
Penyimpanan Komponen Darah
A.
Penyimpanan darah secara invitro merupakan upaya untuk mengurangi perubahan-
perubahan yang terjadi selama darah disimpan. Untuk dapat mempertahankan kualitas darah
donor harus, maka harus memperhatikan syarat – syarat dalam penyimpanan darah invitro.
Pada keadaan invivo ada keseimbangan antara produksi dan destruksi, sintesa dan
pemecahan protein dan lain-lain. Sel darah memerlukan energi untuk mempertahankan
bentuk sel dan melakukan fungsi sel. Untuk mendapatkan energi ini sel perlu
metabolisme yang memerlukan bahan serta memerlukan oksigen terutama untuk trombosit
dan leukosit.
Metabolisme eritrosit merupakan proses glikolitik atau pemecahan glukosa, pada proses
ini memerlukan hampir 20 macam enzim, memerlukan 2 mol ATP, memproduksi 4 mol ATP
dengan hasil akhir 2 mol ATP. ATP yang dihasilkan ini merupakan sumber energi dan hasil akhir
proses glikolitik adalah asam laktat.
Pada penyimpanan darah invitro seperti dalam kantong darah tidak ada keseimbangan
antara produksi dan destruksi ataupun sintesa dan pemecahan protein, hanya ada destruksi
tanpa produksi. Sehinggga sel darah memerlukan energi untuk metabolisme dan itu
memerlukan bahan-bahan serta oksigen. Cara yang paling efektif yaitu disimpan pada
temperatur rendah 2°- 6°C, sehingga metabolismenya diperlambat dan pemberian cadangan
kalori yaitu dekstrosa.
B. SYARAT –SYARAT PENYIMPANAN DARAH SECARA INVITRO
Cara penyimpanan darah secara invitro harus dapat memenuhi syarat-syarat, berikut :
1) Harus mempertahankan sel darah tetap hidup.
2) Harus mempertahankan sel darah tetap berfungsi
Ada 2 faktor penting yang harus diperhatikan dalam penyimpanan darah secara invitro,
yaitu temperatur simpan dan pengawet / pelindung. Dalam perkembangannya pengawety
darah dipakai untuk menyimpan darah dalam bentuk cair, semakin lama semakin dilengkapi
komposisinya dengan tujuan agar masa simpan darah invitro dapat diperpanjang.
Antikoagulan adalah zat untuk mencegah terjadinya darah membeku, yang dipakai
dalam kepentingan transfusi adalah sitrat. dipakai karena dapat mempertahankan darah
teatp cair dengan cara mengikat kalsium (Ca2+) dalam darah, aman bagi manusia, efek samping
keracunan terjadi apabila dipakai dengan konsentrasi tinggi berupa gejala kesemutan
1
sekitar mulut, rasa tertekan pada diafragma akibat turunnya kadar kalsium (Ca2+) dalam darah.
Netralisasi sitrat dengan memberikan kalsium glukonas 10% sebanyak 10 mL untuk dewasa
dan 4-6 mL untuk bayi. Keracunan dapat terjadi pada transfusi masif dan cepat, transfusi pada
pasein gangguan hati, transfusi tukar pada bayi 5 mL/unit. Sedangkan bahan pengawet yaitu
bahan-bahan yang diperlukan untuk metabolisme sel. Berikut ini adalah jenis antikoagulan
dan pengawet darah dalam penyimpanan bentuk cair, antara lain :
1) Natrium sitrat konsentrasi 3,4 – 3,8 %, dapat mengawetkan darah selama 2-3 hari pada
suhu 4°C.
2) ACD = Acid – Citric – Dextrose, dengan penambahan dektrosa masa simpan dapat
diperpanjang menjadi 3 minggu (21 hari).
3) CPD = Citric – Phosphate – Dextrose, dengan penambahan senyawa phospat, maka sel
darah mendapat tambahn sumber energi. Larutan CPD lebih baik jika dibandingkan
larutan ACD, yaitu hemolisis lebih kecil dan viabilitas sel post transfusi juga lebih baik, dan
fungsi transpot oksigen lebih baik. Masa simpan darah dalam larutan CPD adalah 28 hari.
4) CPD-A = Citric – Phosphate – Dextrose – Adenine, dengan penambahan 17 mg adenin ke
komposisi CPD dapat memperpanjang masa simpan menjadi 35 hari (5 minggu).
5) Larutan aditif, terdiri AS-1 (Adsol), AS-3 (Nutricel) dan AS-5 (Optisol) dapat
memperpanjang masa simpan menjasi 42 hari.
Berikut ini adalah isi dari larutan pengawet yang dipakai dalam kantong darah donor:
Tabel 11. Komposisi antikoagulan dan pengawet dalam kantong darah 450 mL (mg/63 mL)
Tabel 12. Komposisi larutan aditif (mg / 100 mL)
Pada kantong darah 450 ml ada pengawet dan antikoagulan sebanyak 63 ml dan
pada kantong darah 500 ml ada pengawet dan antikoagulan sebanyak 70 ml. Jika volume
darah kurang dari 300 ml, maka ratio volume antikoagulan-pengawet dengan darah adalah
1,4 : 10.
C. PENYIMPANAN DARAH DONOR
Penyimpanan darah donor secara invitro , dibagi menjadi dua yaitu penyimpanan dalam
bentuk cair dan enyimpanan dalam bentuk beku.
2) Penyimpanan dalam bentuk cair.
Temperatur Simpan
− Setiap komponen darah memiliki temperatur simpan optimal yang berbeda-
beda.
− Eritrosit dalam bentuk cair, temperatur optimal 4 ± 2 °C dan metabolisme 1/40
pada suhu 37 °C. Temperatur maksimum dalam penyimpanan darah adalah 10 °C,
jika di atas temperatur ini perusakan eritrosit berlangsung cepat.
Temperetur 0°C dapat merusak eritrosit, karena terjadi pembekuan air yang dapat
merusak membran sel kecuali dengan proses tertentu.
Temperatur simpan komponen darah dalam bentuk cair :
Tabel 13. Temperatur simpan komponen darah dalam bentuk cair
Temperatur Jenis Komponen
4 °C ± 2 °C - Darah Lengkap (whole blood)
- Darah Merah Pekat (PRC)
- Plasma
22 °C ± 2 °C - Trombosit Konsentrat
- Leukosit pekat (Buffy Coat)
1
3) Penyimpanan dalam bentuk beku.
Tujuan penyimoanan darah dalam bentuk beku adalah untuk memperpanjang masa
simpan darah invitro. Komponen darah yang bisa disimpan dalam bentuk beku diantaranya :
erirosit, trombosit, sel induk darah (stem sel). Disamping itu kriopresipitat, dan FFP juga
disimpan dalam bentuk beku. Penyimpanan beku trombosit dinilai kurang efisien karena
kerusakan trombosit pada penyimpanan beku lebih dari 5%.
Untuk menyimpan beku eritrosit, dipakai pelindung gliserol dalam kadar yang kecil
gliserol tidak toksik bagi tubuh. Untuk menyimpan beku sel induk darah (stem sel) dan
trombosit dipakai Dimetil Sulfoksida (DMSO).
Tabel 14. Temperatur simpan komponen darah dalam bentuk beku
Temperatur Jenis Komponen
-18 °C ± -30 °C - Plasma Segar Beku (FFP)
- Kriopresipitat
-85 °C - Sel darah merah pekat (PRC)
- Sel Induk Darah (Stem Sel)
-196 °C - Sel Induk Darah (Stem Sel)
3) Masa simpan komponen darah
Tabel di bawah ini menggambarkan lama simpan masing-masing komponen darah.
Tabel 15. Lama Simpan Komponen Darah
4) Alat-alat penyimpanan darah secara invitro
Berikut ini adalah alat-alat yang dipakai untuk penyimpanan komponen darah.
(A) UPRIGHT REFRIGERATOR
(B) CEST REFRERIGERATOR
1
(C) AGITATOR
(D) Ice-lined blood bank refrigerators
(E) COLD ROOM
Gambar 3.33. alat penyimpanan darah secara invitro
D. EFEK PENYIMPANAN DARAH INVITRO
1) Perubahan bentuk dan daya hidup sel
− Daya hidup eritrosit akan menurun sebanding dengan masa simpan. Pada saat
penyadapan hancur 1-5%, apabila disimpan 2 minggu dalam ACD sel erirosit hancur
sekitar 10%, dan 4 minggu dalam ACD sel eritrosit musnah mencapai 25%.
− Daya hidup trombosit menurun sebanding dengan masa simpan dan temperatur
simpan. Daya hidup trombosit pada suhu 2-6°C lebih buruk dibandingkan pada suhu 18-
22°C.
− Daya hidup leukosit menurun dengan cepat sebanding dengan masa simpan. Masa
simpan 48 jam terjadi perubahan bentuk, sedangkan masa simpan 72 jam fungsi leukosit
hilang.
2) Perubahan kadar ATP
Akibat penurunan kadar ATP, maka terjadi hilangnya lipid membran sel, perubahan
bentuk sel dari bentuk bikonkaf menjadi bulat, berkurangnya elastisitas sel sehingga
menjadi kaku.
3) Perubahan kadar 2,3 DPG
Akibat penurunan kadar 2,3 DPG, maka daya ikat oksigen pada molekul hemoglobin
menjadi kuat, pelepasan oksigen ke jaringan menjadi berkurang. Darah dengan 2,3 DPG
rendah tidak menambah oksigenisasi jaringan walaupun kadar hemoglobin naik. Darah
dengan 2,3 DPG rendah tidak tepat untuk pasien yang memerlukan oksigenisasi cepat /
resusitasi.
4) Perubahan elektrolit
Peningkatan Kalium (K+) plasma, disebabkan karena sel tidak mampu mempertahankan
Kalium (K+) dalam sel, akibatnya masuknya natrium (Na+) beserta air ke dalam sel. Darah
dengan kalium plasma yang tinggi kurang tepat untuk penderita penyakit ginjal.
5) Perubahan asam laktat dan pH
Perubahan pH disebsbkan penumpukan asam laktat sebagai hasil akhir proses glikolitik
oleh sel eritrosit. Dengan bertambahnya asam laktat akan memicu penurunan pH
(asam)
6) Perubahan amonia
Disebabkan penghancuran / destruksi protein. Darah dengan amoniak plasma yang tinggi
kurang tepat untuk penderita penyakit hati.
7) Peningkatan Hb plasma
Peningkatan Hb plasma dikarenakan banyaknya eritrosit yang lisis.
8) Perubahan faktor pembekuan
Diantara faktor pembekuan F I sampai dengan F XIII, F V dan F VIII merupakan faktor
pembekuan labil secara invitro. Faktor ini hanya bertahan selama 4-6 jam dalam keadaan
invitro, sehingga darah simpan tidak mengandung F V dan F VIII (labile factor).
9) Perubahan metabolisme sel
Perubahan pH menjadi asam memicu terganggunya fungsi enzim-enzim untuk
metabolisme sel, sehingga mmetabolisme sel terganggu dan sel akan lisis.
Tabel di bawah ini menggambarkan perubahan biokima sel darah putih dan sel darah
merah selama penyimpanan secara invitro.
Tabel Perubahan biokima sel darah putih dan sel darah merah
Glosarium
Unit Transfusi Darah : fasilitas pelayanan kesehatan yang menyelenggarakan donor darah,
penyediaan darah, dan pendistribusian darah.
Voluntery Blood Donors : donor sukarela yang memberikan darah, plasma atau komponen
darah lainnya atas kehendaknya dan tidak menerima pembayaran, baik dalam bentuk tunai
atau hal lainnya sebagai pengganti uang.
Transfer bag : merupakan kantung darah yang terbuat Polivinil Klorida (PVC ) dan telah di
sterilkan dengan berbagai ukuran 150 mL, 250 mL, 350 mL, 450 mL yang dipakai untuk
pemisahan dan penyimpanan komponen darah.
Faksionasi : proses pemisahan sejumlah plasma yang dipisahkan selama transisi fasa menjadi
sejumlah kecil bagian (fraksi-fraksi), yang mana komposisinya bervariasi sesuai gradiennya.
Demam anafilaktoid : sindrom klinis akibat reaksi analogis (reaksi alergi) yang bersifat
sistemik serta cepat dan memicu gangguan respirasi, sirkulasi, pencernaan dan kulit.
Bab 4
REAKSI TRANSFUSI
ransfusi merupakan pengobatan yang dipakai untuk menyembuhkan pasien dari
kondisi yang dapat mengancam jiwa atau dapat juga sebagai terapi jangka panjang
terhadap suatu penyakit tertentu. Mengingat fungsinya yang sangat vital, oleh karena
itu, proses transfusi harus dilakukan sebaik dan se-aman mungkin, sehingga pasien mendapat
manfaat dari proses transfusi ini .
Proses transfusi tidak lepas dari resiko komplikasi atau reaksi yang menimbulkan gejala
klinis pada pasien. Gejala klinis yang timbul pada pasien bervariasi, dari yang ringan sampai
dengan berat, yang bisa saja membahayakan kondisi pasien. Gejala klinis yang timbul karena
reaksi transfusi bervariasi, bisa berupa demam, mual, ada bercak merah di kulit, sesak
napas hingga dapat mengakibatkan kematian pasien. Umumnya reaksi ini , terjadi
karena ketidakcocokan (inkompatibilitas) antara darah donor dan pasien. Selain itu, reaksi
transfusi, juga dapat terjadi pada komponen darah dengan kualitas yang kurang baik.
Setiap reaksi yang terjadi, dapat memberikan gejala klinis yang khusus maupun umum.
Gejala klinis yang timbul pada pasien transfusi, dapat terjadi pada kisaran 24 jam semenjak
proses transfusi (reaksi transfusi akut) atau setelah 24 jam paska transfusi (reaksi transfusi
tunda). Reaksi ini dapat melibatkan sistem imun (reaksi Ag dan Ab) ataupun tidak (non
imun).
Pada bab ini, pembahasan mengenai reaksi transfusi, terdiri atas dua topik, yaitu : topik
1 membahas reaksi transfusi imun yang terdiri atas reaksi transfusi imun akut dan tunda
beserta cara pencegahannya dan topik 2 membahas reaksi transfusi non imun akut dan tunda
serta cara pencegahannya. Penatalaksanaan dan pengobatan karena reaksi transfusi tidak
dibahas pada modul ini, mengingat ruang lingkup pekerjaan teknologi laboratorium medik
tidak ke ranah klinis atau tidak melakukan penanganan terhadap pasien.
Setelah mempelajari bab ini, anda diharapkan dapat :
1. Menguraikan konsep dasar reaksi transfusi.
2. Mendeskripsikan jenis reaksi transfusi imun (akut dan tunda), non imun (akut dan tunda).
T
3. Mendeskripsikan gejala klinis yang ditimbulkan karena reaksi transfusi.
4. Menguraikan cara pencegahan reaksi transfusi.
1
Topik 1
Reaksi Transfusi Imun
A. KONSEP DASAR
Reaksi transfusi imun yang dimaksud adalah semua jenis reaksi yang terjadi pada pasien
saat proses transfusi dan setelah transfusi. Reaksi ini , terjadi melalui mekanisme imun
tubuh, melibatkan antigen (Ag) dan antibodi (Ab). Reaksi imun yang terjadi, mengakibatkan
timbulnya gejala klinis pada pasien. Gejala klinis yang timbul bervariasi, mulai dari gejala
ringan sampai berat dan bersifat akut atau tunda.
Seperti dijelaskan di paragraf awal, bahwa reaksi transfusi imun terjadi karena reaksi Ag
dan Ab. Ag yang dimaksud di sini adalah Ag sel darah dan Ab yang berasal dari plasma. Seperti
sudah dijelaskan di Bab 1, bahwa membran sel darah kita terdiri atas unsur protein,
karbohidrat dan lipid. Molekul ini dapat menjadi Ag dan memicu respon imun jika
dipaparkan ke pasien lain.
Jenis Ag yang ada pada sel darah merah, lekosit dan trombosit serta Ab yang
terbentuk karena paparan terhadap Ag ini dikategorikan ke dalam suatu sistem. Ag dan
Ab pada sel darah merah dikelompokkan ke dalam sistem golongan darah. Ag dan Ab pada
lekosit dikelompokkan ke dalam sistem human leucoyte antigen (HLA) dan human neutrofil
antigen (HNA). Ag dan Ab pada trombosit dikelompokkan ke dalam sistem human platelet
antigen (HPA). Adanya ketidakcocokan antara darah donor dengan pasien yang melibatkan Ag
dan Ab pada darah dapat memicu reaksi transfusi imun.
Jenis Ab pada sistem golongan darah dapat mempengaruhi berat atau tidaknya reaksi
transfusi. Untuk meminimalisir dan mencegah reaksi transfusi, maka sebelum dilakukan
transfusi darah, dilakukan pemeriksaan terlebih dahulu yang mencakup kecocokan jenis
golongan darah dan reaksi antara darah donor dan pasien secara in vitro/di luar tubuh.
Pemeriksaan ini disebut dengan pemeriksaan pre-transfusi (akan dibahas pada bab 6).
Jenis reaksi imun yang akan dibahas pada topik ini, yaitu : reaksi transfusi imun akut
(hemolitik, febrile non hemolytic transfusion reaction (FNHTR), alergi, reaksi anafilaktik dan
anaphylactoid, transfusion related acute lung injury / TRALI). Reaksi transfusi imun tunda
(hemolitik, aloimunisasi, post transfusion purpura (PTP), transfusion associated graft versus
host disease / TA-GVHD).
B. REAKSI IMUN AKUT
B.1 Reaksi hemolitik akut
Reaksi hemolitik akut merupakan jenis reaksi transfusi yang berbahaya dan dapat
memicu kematian. Reaksi hemolitik merupakan reaksi lisis sel darah merah dari darah
donor ataupun darah pasien karena adanya ketidakcocokan jenis golongan darah antara
donor dan pasien.
Hemolisis dapat terjadi karena interaksi Ab pada plasma pasien dan Ag sel darah merah
donor yang disebut dengan inkompatibilitas mayor atau dapat juga karena interaksi plasma
donor dengan Ag sel darah merah pasien yang disebut dengan inkompatibilitas minor. Selain
itu, ada juga inkompatibilitas inter donor yaitu reaksi Ab pada plasma donor dengan Ag
sel darah merah donor lainnya jika pasien mendapat transfusi darah lebih dari satu donor
yang bereaksi pada darah pasien. Reaksi hemolitik akut terjadi sesaat setelah transfusi dan
berlangsung cepat. Jenis Ab pada sistem golongan darah merah yang lebih sering
memicu reaksi imun hemolitik akut adalah : anti-A, anti-Kell, anti-Jka dan anti-Fya.
Mekanisme lisis sel darah merah karena reaksi transfusi dapat terjadi melalui
mekanisme hemolisis ekstravaskular maupun intravaskular.
B.1.1. Hemolisis ekstravaskular
Hemolisis ekstravaskular merupakan lisis sel darah merah yang terjadi karena reaksi Ag
donor yang disensitisasi/dilekati oleh Ab dan atau komplemen pasien. Kompleks Ag, Ab dan
atau komplemen ini dikenali dan disingkirkan ke luar pembuluh darah oleh sel makrofag
menuju ke hati atau limpa untuk dihancurkan. Pada saat makrofag menempel dan terikat pada
sel darah merah, maka proses fagositosis dapat terjadi melalui tiga cara, yaitu :(i) sel darah
merah difagositosis dan dihancurkan di dalam makrofag, (ii) sel darah merah difagositosis dan
dihancurkan sebagian, sedangkan sisanya dapat tidak terfagositosis dan beredar di sirkulasi
sebagai sel sferosit yang memiliki masa hidup pendek, (iii) sel darah merah berada di luar
makrofag dan dilisiskan melalui mekanisme antibody-dependent cell-mediated cytotoxicity
(ADCC), yaitu makrofag mengeluarkan substan yang bersifat toksik, sehingga sel darah merah
yang menempel pada makrofag dapat lisis, tanpa melisiskan makrofag. Mekanisme fagositosis
dapat dilihat pada Gambar 4.1 berikut ini.
1
Gambar 4.1. Mekanisme fagositosis
Sumber. Transfussion journal
Pada saat sel darah merah dihancurkan di dalam makrofag (Gambar 4.2), maka akan
melepaskan molekul Hb dari sel darah merah yang kemudian dipecah menjadi bagian heme
dan globin. Protein globin akan dimanfaatkan kembali oleh tubuh, sedangkan molekul heme
diubah menjadi biliverdin yang pada proses berikutnya akan diubah menjadi bilirubin indirek.
Bilirubin indirek akan dibawa ke hepatosit untuk dirubah menjadi bilirubin direk (larut dalam
air). Pada hemolisis ekstravaskular, biasanya konsentrasi bilirubin indirek meningkat, karena
terlalu banyak molekul heme yang diubah menjadi bilirubin, sampai hepatosit tidak mampu
memproses kelebihan bilirubin.
Bilirubin direk kemudian dieksresikan ke dalam sistem gastrointestinal yang kemudian
diubah menjadi urobilinogen dan dieksresikan melalui feses dalam bentuk sterkobilinogen.
Jenis Ab yang bereaksi dengan Ag pada reaksi hemolisis ekstravaskular adalah jenis Ab
yang tidak mengaktifkan komplemen, seperti : Rh, Duffy, Kell. Mekanisme lisis ekstravaskular
dapat dilihat pada Gambar 4.2.
Gambar 4.2. Mekanisme hemolisis ekstravaskular
Sumber. http://pedsinreview.aappublications.org
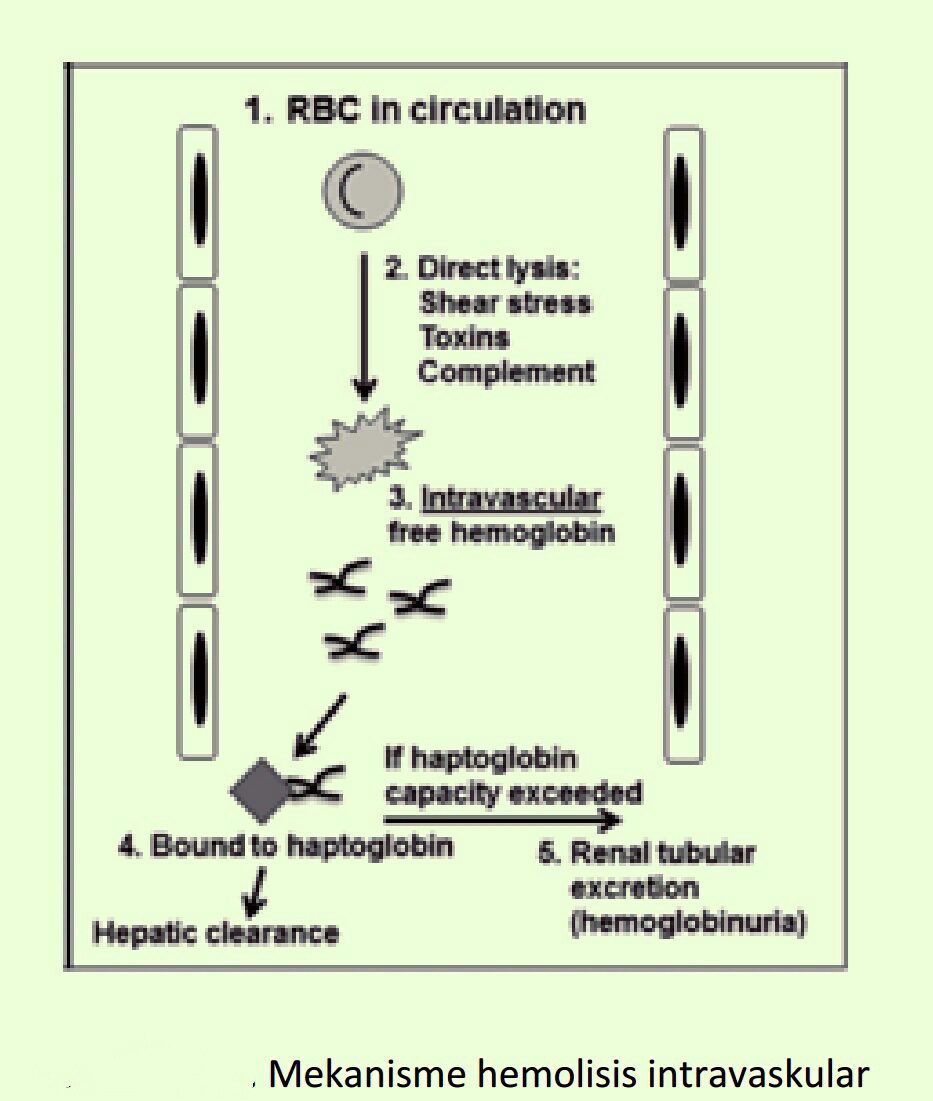
B.1.2. Hemolisis intravaskular
Hemolisis intravaskular merupakan lisis sel darah merah yang terjadi di pembuluh darah.
Reaksi terjadi jika Ab pasien bereaksi dengan Ag yang berasal dari donor. Ikatan Ag dan Ab
ini mengaktifkan komplemen dan membentuk membrane attachment complex (MAC)
dan sel darah merah lisis/pecah . Molekul Hb yang keluar dari sel darah merah yang telah lisis
akan diikat oleh haptoglobin. Kompleks Hb-haptoglobin akan disingkirkan dari plasma oleh sel
retikuloendotelial hati. Jika jumlah haptoglobin berkurang atau bahkan habis, maka molekul
Hb akan berada bebas di dalam darah (hemoglobinemia), sehingga ikut tersaring di ginjal dan
Hb dapat berada di urin (hemoglobinuria), sehingga mengakibatkan warna urin menjadi
merah/gelap.
Sebagai contoh, pasien golongan darah O ditransfusi dengan darah golongan A, maka
anti A pasien akan bereaksi dengan Ag A dari darah donor. Komplemen akan teraktifkan dan
mengakibatkan sel darah merah lisis. Jenis Ab yang dapat memicu reaksi hemolisis
intravaskular selain anti A dan anti B adalah anti-Jka, -Jkb, Vel, -PP1PPk, -Lea. Mekanisme
hemolisis intravaskular dapat dilihat pada Gambar 4.3 berikut ini.
1
Gambar 4.3. Mekanisme hemolisis intravaskular
Sumber. http://pedsinreview.aappublications.org
Perbedaan klinis antar kedua jenis hemolisis, yaitu intravaskular dan ekstravaskular,
melibatkan banyaknya sel darah merah yang dihancurkan. Hemolisis ekstravaskular terbatas
pada kapasitas sistem retikuloendotelial (RES) dalam menghancurkan sel darah merah.
Sebagai contoh, pada pasien dengan berat badan 70 Kg, RES dapat menghancurkan sel darah
merah sebanyak 18 mL pada komponen Packed Red Cells dalam waktu 1 jam, dan lebih dari
400 mL selama 24 jam. Sementara, hemolisis intravaskular dapat menghancurkan 200 mL sel
darah merah atau lebih, dalam waktu 1 jam. Kondisi ini dapat menurunkan kadar Hb sebanyak
5 g/dL dalam waktu 1 jam, yang dapat berakibat fatal jika tidak segera ditransfusikan dengan
darah yang sesuai.
Hemolisis ekstravaskular terjadi karena adanya aktivasi makrofag yang akan
memfagositosis ikatan Ag, Ab dan atau komplemen yang tidak membentuk MAC, proses
lisis lebih banyak terjadi di luar pembuluh darah, sedangkan hemolisis intravaskular
terjadi karena adanya aktivasi komplemen sampai membentuk MAC sehingga sel darah
merah lisis di dalam pembuluh darah.
Setelah membaca penjelasan mengenai hemolisis intravaskular dan ekstravaskular, jawablah
pertanyaan berikut :
Sebutkan minimal tiga perbedaan antara lisis ekstravaskular dan intravaskular.
No. Perbedaan Hemolisis ekstravaskular Hemolisis intravaskular
1
2
3
Reaksi hemolitik akut dapat terjadi melalui mekanisme lisis intravaskular maupun
ekstravaskular. Penyebab reaksi hemolitik akut, yang paling utama adalah inkompatibilitas
golongan darah ABO. Jenis inkompatibilitas ini, seringkali disebabkan karena kesalahan
interpretasi golongan darah atau adanya kesalahan penulisan label antara komponen darah
donor dan pasien.
Pada awalnya, gejala klinis hemolitik akut seringkali tidak spesifik. Jika reaksi terjadi pada
pasien dengan kondisi sadar, maka tubuh pasien menggigil, pasien akan merasakan panas di
area infus, nyeri di bagian dada, perut atau punggung, kepala pusing, mual dan muntah. Gejala
lainnya yang dapat terjadi pada pasien yang tidak sadarkan diri, seperti, demam (peningkatan
suhu tubuh > 10 C), perubahan kondisi kulit (seperti pembengkakan/oedem, pucat), takikardia
(detak jantung di atas normal), tekanan darah di bawah nilai normal (hipotensi), dan
perubahan warna urin menjadi kemerahan karena adanya Hemoglobin (Hb) pada urin. Pasien
dapat mengalami reaksi koagulasi intravaskular diseminata (disseminated intravascular
1
coagulation/DIC) karena adanya perdarahan cukup luas yang dapat memicu faktor koagulasi
pasien bekerja ekstra sehingga terbentuk bekuan dan menutup pembuluh darah. Selain itu
pasien dapat mengalami anuria karena ginjal tidak dapat memproduksi urin (gagal ginjal).
Kondisi ini dapat memicu kematian pasien.
Gejala klinis reaksi hemolitik akut intravaskular lebih berat dibandingkan hemolisis
ekstravaskular.
B.2. Febrile non hemolytic transfusion reaction (FNHTR)
FNHTR merupakan reaksi transfusi dengan gejala klinis yang ditimbulkan berupa demam
dan tidak diikuti dengan reaksi hemolisis sel darah merah. Reaksi FNHTR terjadi karena
dilepaskannya sitokin dari sel lekosit. Pelepasan sitokin dari sel lekosit dapat terjadi melalui
tiga mekanisme yang dapat dilihat pada Gambar 4.4, yaitu : (A) Sel lekosit donor yang dapat
mengaktivasi sistem imun pasien, sehingga lekosit pasien menghasilkan dan melepaskan
sitokin. (B) Reaksi antara Ab lekosit pada plasma pasien dengan komponen darah donor yang
mengandung Ag lekosit (HLA/HNA) yang sesuai. Ab akan bereaksi dengan lekosit membentuk
kompleks Ag – Ab dan memicu dilepaskannya sitokin. Mekanisme ketiga (C) yaitu sitokin
dilepaskan oleh sel lekosit selama proses penyimpanan komponen darah.
Sitokin yang dilepaskan melalui berbagai mekanisme ini akan merangsang
hipotalamus sehingga pasien merasakan demam. Mekanisme pelepasan sitokin dapat dilihat
pada Gambar 4.4.
Gambar 4.4. Mekanisme pelepasan sitokin pada reaksi FNHTR
Sumber. https://www.researchgate.net
FNHTR terjadi jika ada kenaikan suhu tubuh > 1O C pada saat atau selama 24 jam
paska transfusi yang disertai dengan gejala menggigil, demam, sakit kepala, nyeri otot. Selain
itu, pasien dapat menderita hipotensi, muntah dan pernapasan terganggu.
B.3. Alergi
Reaksi alergi merupakan jenis reaksi transfusi yang cukup sering terjadi. Reaksi ini terjadi
karena berbagai unsur yang bertindak sebagai alergen yang dapat mengaktifkan sel mast
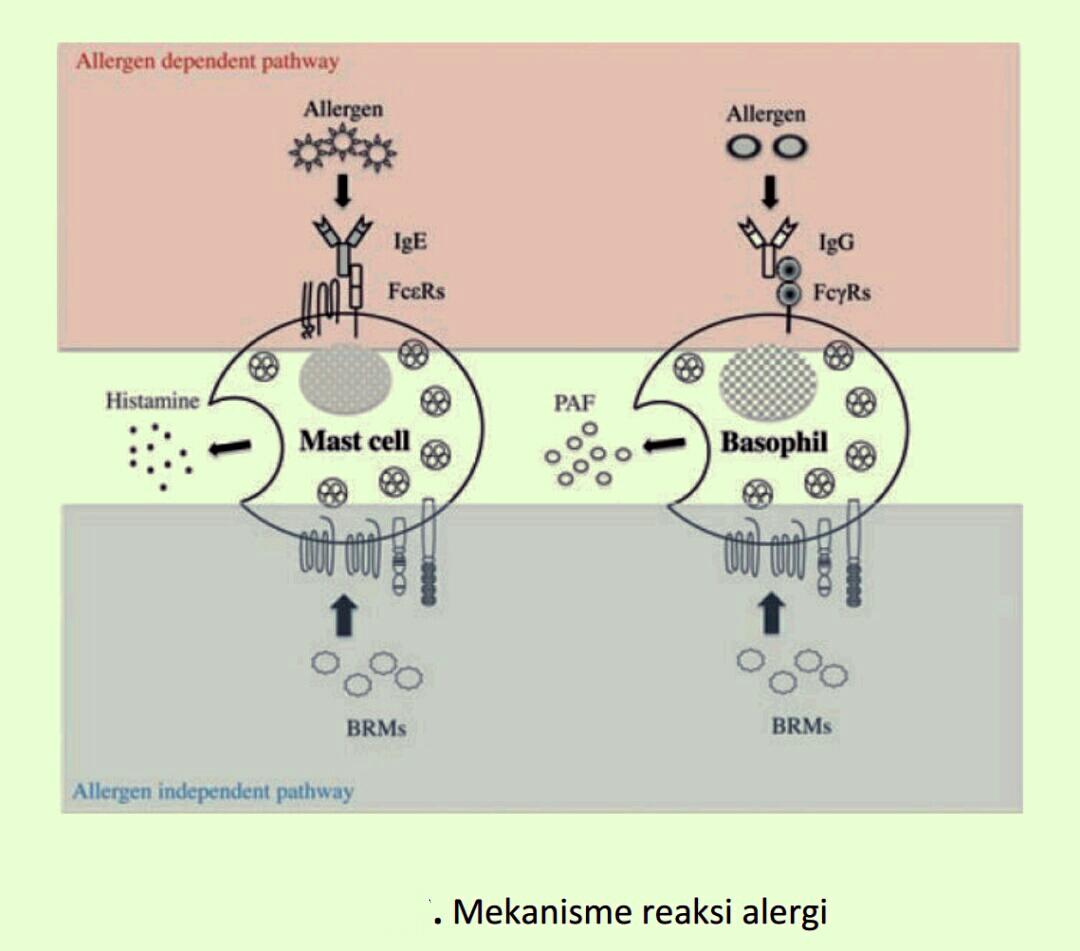
maupun basofil. Mekanisme terjadinya reaksi alergi terbagi melalui tiga jalur, yaitu :
1. Allergen dependent pathway (yang ditunjukkan dengan warna pink pada Gambar 4.5.)
memiliki mekanisme yaitu alergen yang dapat berupa protein plasma, protein
makanan ataupun zat kimia seperti methylen blue akan terikat pada Ab (IgE/IgG) yang
kemudian akan menempel dan terikat pada reseptor (FcRs) sel mast maupun basofil. Sel
yang teraktivasi mengeluarkan substan kimia, seperti histamin maupun platelet activating
factor (PAF). Pada reaksi alergi yang melibatkan sel mast, (allergen-dependent-mast cell
mediated sub-pathway), unsur lain yang terlibat adalah IgE dan FcƐRs, sehingga sel mast
teraktifkan dan menghasilkan substan histamin . Pada reaksi alergi yang melibatkan sel
basofil (allergen-dependent-basophil mediated sub-pathway) , unsur lain yang terlibat
adalah IgG dan FcƳRs sehingga sel basofil teraktifkan dan melepaskan substan PAF.
2. Allergen independent pathway (yang ditunjukkan dengan warna biru muda pada Gambar
4.5. memiliki mekanisme alergen yang disebut dengan biological response modifiers
(BRMs) berupa sitokin yang dihasilkan selama proses penyimpanan komponen darah.
BRMs dapat terikat langsung ke reseptor (FcRs) sel mast maupun basofil, sehingga sel
teraktivasi. Mekanisme reaksi alergi dapat dilihat pada Gambar 4.5.
1
Gambar 4.5. Mekanisme reaksi alergi
Sumber. British Journal of Haematology
Pelepasan substan karena adanya aktivasi sel mast, yaitu histamin akan memicu
vasodilatasi (pelebaran pembuluh darah) yang ditandai dengan warna kulit kemerahan. Gejala
klinis lainnya yang dapat dirasakan pasien adalah gatal, pembengkakan pada area wajah,
termasuk bibir atau mulut. Jika kondisi semakin parah, pasien dapat kesulitan bernapas.
Reaksi alergi biasanya terjadi pada saat transfusi atau satu jam setelahnya.
B.4. Reaksi anafilaktik dan anaphylactoid
Reaksi anafilaktik dan anaphylactoid merupakan reaksi hipersensitivitas pada respon
sistem imun yang merupakan bagian dari reaksi alergi. Komplikasi ini jarang terjadi, namun
dapat membahayakan jiwa pasien. Reaksi dapat terjadi pada pasien dengan
defisiensi/kekurangan terhadap jenis Ab / immunoglobulin / protein tertentu, dalam hal ini
adalah defisiensi terhadap immunoglobulin A (IgA), sehingga ada Ab terhadap IgA karena
adanya riwayat paparan dengan IgA sebelumnya. Gejala klinis pasien akan terjadi setelah
Alergen yang dapat memicu reaksi alergi, bisa berasal dari darah donor ataupun
pasien yang akan bereaksi dengan Ab yang berasal dari darah pasien maupun
komponen darah donor.
transfusi beberapa mL plasma atau transfusi komponen darah yang ada plasma di
dalamnya.
Reaksi anafilaktik dan anaphylactoid dibedakan dari jenis IgA yang lebih spesifik dan
gejala klinisnya. Reaksi anafilaktik, yaitu reaksi terhadap pasien dengan defisiensi IgA,
sehingga memiliki anti-IgA dari paparan sebelumnya. Gejala klinis reaksi anafilaktik berupa
: batuk, sesak napas, mual, muntah, sakit di bagian dada, hipotensi, diare, bisa memicu
shock, hilang kesadaran yang dapat berujung pada kematian. Reaksi anaphylactoid terjadi
pada pasien dengan konsentrasi IgA normal, tetapi memiliki beberapa jenis IgA yang dapat
bereaksi dengan bagian rantai ringan (light chain) IgA donor. Reaksi anaphylactoid, biasanya
tidak separah reaksi anafilaktik, dengan gejala klinis berupa : urtikaria, sesak napas.
B.5. Transfusion related acute lung injury (TRALI)
TRALI merupakan reaksi transfusi yang dapat membahayakan jiwa pasien, hal ini
disebabkan karena organ yang diserang adalah paru-paru, sehingga pasien mengalami sulit
napas. Gejala klinis, biasanya terjadi pada kisaran 6 jam selama proses transfusi.
TRALI disebabkan oleh Ab terhadap lekosit (anti-HLA) atau Ab terhadap sel netrofil (anti-
HNA) pada plasma donor. Ab yang berasal dari donor diperoleh dari riwayat paparan Ag
sebelumnya pada donor, yang disebabkan, donor pernah transfusi darah sebelumnya atau
donor memiliki riwayat melahirkan beberapa kali (wanita multipara).
Ab yang ada di plasma dapat mengaktivasi netrofil pasien pada saat ditransfusikan.
Sel netrofil bermigrasi ke paru-paru dan menempel pada bagian kapiler paru, serta
melepaskan berbagai macam substan, seperti enzim proteolitik, oksigen yang bersifat radikal
bebas. Pelepasan berbagai macam substan ini akan merusak sel endotel kapiler paru,
yang berakibat pada kebocoran kapiler, sehingga cairan dan protein akan keluar menuju
alveoli dan berakibat pembengkakan pada paru-paru. Mekanisme reaksi TRALI dapat dilihat
pada Gambar 4.6. berikut. Gejala klinis yang timbul pada pasien berupa demam, hipotensi,
sesak napas, penurunan tekanan oksigen di dalam tubuh. Pada kondisi ini, pasien
membutuhkan suplai oksigen.
Gambar Mekanisme reaksi TRALI
Ket. gambar : Anti-HNA / anti-MHC kelas I / anti-HLA yang berasal dari komponen darah yang ditransfusikan
dapat mengaktivasi netrofil yang ada pada pembuluh darah kapiler. Anti MHC kelas I juga dapat langsung
mengenali dan menempel pada MHC kelas I di endotel pembuluh darah. Selain itu, kompleks imun antara anti
HNA / anti MHC kelas I dan HNA / MHC kelas I terlarut juga dapat mengaktifasi netrofil. Aktivasi netrofil pada
pembuluh darah kapiler memicu kerusakan sel endotel kapiler.
C. REAKSI IMUN TUNDA
C.1. Reaksi hemolitik tunda
Reaksi hemolitik tunda disebabkan karena respon imun sekunder terhadap Ag pada sel
darah merah donor. Hal ini terjadi karena pasien sudah pernah terpapar dengan jenis Ag yang
sama sebelumnya sehingga pasien sudah memiliki Ab terhadap Ag ini . Jenis Ab pada
respon imun sekunder, biasanya adalah jenis IgG yang berada pada jumlah maksimal selama
3 – 7 hari setelah paparan dengan Ag yang sesuai. Pada kisaran hari ini , sel darah merah
donor masih berada di aliran darah pasien, dan dapat dihancurkan secara cepat karena
bereaksi dengan Ab yang sesuai.
Ab yang dapat memicu reaksi hemolitik tunda , adalah Ab yang berasal dari sistem
Rh, Kidd, Duffy, Kell dan MNSs. Jenis Ab ini adalah anti-c, anti-E, anti-Jka, anti-K, anti-Fya,
anti-Jkb, anti-M, anti-s, anti-Fyb, anti-Fy3, anti-Kpa, anti-N dan anti-U.
Gejala klinis pada pasien dengan reaksi transfusi tunda lebih ringan dibandingkan reaksi
transfusi akut. Gejalanya antara lain : demam dan gejala anemia. Adanya penurunan Hb dan
ikterus dapat terjadi 1 minggu setelah transfusi, terkadang dapat terjadi hemoglobinuria,
namun tidak sampai terjadi gagal ginjal.
C.2. Aloimunisasi
Reaksi komplikasi jangka panjang karena transfusi, salah satunya adalah reaksi
aloimunisasi yaitu terbentuknya Ab terhadap paparan dengan Ag sel darah merah, lekosit
maupun trombosit sebelumnya. Reaksi aloimunisasi biasanya terjadi pada pasien yang
mendapat beberapa kali transfusi darah.
Gejala klinis yang timbul, biasanya tidak terlalu parah, seperti demam dan penurunan
konsentrasi Hb. Namun demikian, reaksi aloimunisasi dapat memiliki gejala klinis yang
berat jika terjadi perdarahan, sebagai contoh : pada transfusi trombosit terjadi reaksi antara
Ab trombosit pada pasien dengan trombosit yang ditransfusikan, sehingga terjadi penurunan
trombosit yang signifikan (trombositopenia), jika reaksi berlanjut dapat memicu
perdarahan. Jika allo Ab yang terbentuk memiliki reaksi yang kuat, efeknya dapat sulit
untuk menemukan komponen darah yang sesuai pada transfusi berikutnya.
Untuk deteksi ada tidaknya reaksi aloimunisasi, dapat dilakukan pemeriksaan Coomb’s
test maupun skrining dan identifikasi Ab.
C.3. Post transfusion purpura (PTP)
PTP merupakan reaksi transfusi yang melibatkan komponen trombosit. Kondisi ini
terjadi karena reaksi allo Ab terhadap trombosit yang ditransfusikan. Allo Ab trombosit
melekat pada permukaan trombosit yang memicu dekstruksi ekstravaskular oleh
retikuloendotelial sistem (RES), sehingga terjadi penurunan jumlah trombosit
(trombositopenia).
Gejala klinis pada pasien seperti demam, hipotensi berasal dari aktivitas sitokin yang
dilepaskan sel lekosit yang distimulus pada reaksi hemolisis intravaskular maupun
ekstravaskular.
Gejala klinis yang terjadi berupa purpura (kulit kemerahan) dan trombositopenia
sekitar 1 – 2 minggu setelah transfusi. Trombositopenia berat dapat terjadi dengan penurunan
jumlah trombosit sampai 10.000/µL darah. Reaksi ini dapat mendorong terjadinya
hematuria, perdarahan pada saluran pencernaan sehingga terjadi kondisi melena.
C.4. Transfusion-associated graft vs host disease (TA-GVHD)
Reaksi ini cukup jarang terjadi pada transfusi, namun dapat bersifat fatal. Reaksi yang
terjadi adalah limfosit T donor yang memicu sistem imun pasien. Sel limfosit donor dikenali
sebagai substan asing oleh sistem imun pasien, sehingga sel limfosit yang ditransfusikan
dihancurkan di dalam tubuh pasien.ada tiga faktor yang dapat mempengaruhi reaksi ini,
yaitu; status imun pasien, kecocokan HLA antara donor dan pasien, dan berapa banyak sel T
yang teraktifkan karena proses transfusi.
Jika darah yang mengandung limfosit ditransfusikan pada pasien dengan gangguan
sistem imun, seperti pasien AIDS atau pada pasien yang sedang terapi penyakit kanker, maka
reaksi TA-GVHD tidak terjadi. Namun demikian, pada kondisi ini , sel limfosit dapat
berproliferasi dan menimbulkan penyakit yang lebih serius. Sel limfosit donor juga tidak
dihancurkan di tubuh pasien, jika HLA donor dan pasien memiliki haplotype yang sama.
Reaksi TA-GVHD seringkali tidak dikenali dan salah diagnosis dengan reaksi sepsis atau
reaksi pengobatan. Gejala klinis terjadi 1 – 6 minggu setelah transfusi, yaitu berupa : diare,
sakit pada bagian perut, mual dan muntah. Jika organ hati terkena, maka terjadi peningkatan
konsentrasi bilirubin. Warna kulit kemerahan jika reaksi mempengaruhi kulit. Reaksi yang
paling fatal terjadi, jika melibatkan sumsum tulang.
D. PENCEGAHAN REAKSI TRANSFUSI IMUN
Terapi transfusi darah memiliki manfaat untuk menyembuhkan pasien bahkan dapat
menyelamatkan jiwa pasien, akan tetapi, proses transfusi memiliki resiko atau efek
samping. Upaya pencegahan-pun dilakukan untuk meminimalisir dan mencegah reaksi
ini .
Upaya yang dilakukan untuk pencegahan reaksi transfusi dimulai dari pengambilan
darah donor, kontrol kualitas komponen darah yang akan diberikan ke pasien sampai dengan
proses distribusi darah ke pasien. Setiap proses yang dilakukan harus terstandar dengan baik
dan dikontrol. Sebagai contoh, penentuan dan penulisan jenis golongan darah donor dan
pasien tidak boleh ada kesalahan, baik pada proses pemeriksaannya, maupun pelaporan dan
penulisan hasil, karena jika terjadi kesalahan dapat fatal akibatnya. Validasi pemeriksaan dan
crosscheck terhadap hasil golongan darah ABO pasien dan donor dapat mencegah kesalahan
penentuan golongan darah donor yang dapat memicu reaksi transfusi hemolitik akut.
Reaksi transfusi hemolitik tunda maupun reaksi aloimunisasi dapat dicegah dengan
melakukan pemeriksaan pre-transfusi yang disertai dengan pemeriksaan khusus skrining dan
identifikasi Ab sebelum proses transfusi dilakukan. Pemeriksaan ini dilakukan untuk
mengetahui ada tidaknya allo Ab yang terbentuk karena riwayat paparan dengan Ag sel darah
merah sebelumnya. Pemeriksaan harus dilakukan pada pasien yang memiliki riwayat
transfusi sebelumnya, terlebih pada pasien yang menjalani terapi transfusi rutin, seperti :
penderita thalasemia. Selain itu, baik dilakukan juga pada pasien yang beresiko terpapar oleh
Ag sel darah merah lain, yaitu pada pasien yang memiliki riwayat pernah melahirkan
beberapa kali (multipara). Pada pencegahan reaksi TRALI yang banyak disebabkan oleh anti-
HNA dapat dilakukan dengan meminimalisir wanita dengan riwayat multipara untuk donor
plasma.
Pembuatan dan pengolahan komponen darah untuk transfusi juga memegang peranan
penting untuk mencegah reaksi transfusi. Reaksi FNHTR, TRALI, PTP dapat dicegah dengan
memberikan komponen darah ‘miskin’ lekosit (leukopoor / leukoreduced), yaitu darah yang
diproses tertentu sehingga lekosit dapat berkurang secara efektif. Proses pengurangan atau
penyingkiran lekosit dapat dilakukan dengan proses penyaringan menggunakan filter khusus
yang ada pada bagian selang kantong darah (
Gambar proses filtrasi lekosit pada sel darah merah
Selain pembuatan komponen darah ‘miskin’ lekosit, cara lainnya untuk menyingkirkan
lekosit maupun trombosit, dapat dilakukan dengan pembuatan komponen ‘washed
erythrocyte’ (WE), yaitu sel darah merah yang dibuang bagian plasmanya dan dicuci dengan
larutan NaCl 0.9%. Komponen WE juga dapat diberikan untuk mencegah reaksi alergi setelah
transfusi. Pada pasien transfusi dengan indikasi alergi, dapat dilakukan tahapan pencegahan,
yaitu : penulisan / dokumentasi riwayat alergi sebelumnya, diberikan obat pencegah alergi,
sebelum transfusi dilakukan dan tranfusi dengan komponen darah yang leukopoor ataupun
komponen darah dengan pengurangan bagian plasma. Komponen darah miskin plasma , juga
baik dipakai untuk mencegah reaksi anafilaktik dan anaphylactoid.
Pasien dengan indikasi klinis ke arah gangguan sistem imun yang dapat mengalami
reaksi transfusi TA-GVHD dapat diberikan komponen darah yang diberi perlakuan radiasi sinar
gamma.
Proses penyimpanan komponen darah juga memberikan efek terhadap reaksi transfusi
darah. Hal ini berkaitan dengan proses metabolisme darah selama proses penyimpanan.
Tempat penyimpanan harus disesuaikan dengan suhu, kapasitas penampungan, supaya
mencegah atau meminimalisir kerusakan komponen darah dan teraktivasinya berbagai
substan sel darah selama penyimpanan. Penggunaan komponen darah PRC dengan masa
simpan < 14 hari dan trombosit < 2 hari dapat mengurangi efek aktivitas Ab, protein dan unsur
biologis lainnya yang ada di dalam plasma.
Dokumentasi terhadap reaksi transfusi baik dipakai untuk mencegah reaksi transfusi
pada pasien dengan kondisi khusus, yaitu : alergi pada protein plasma, reaksi aloimunisasi,
dan sebagainya. Dokumentasi ini dapat dipakai untuk rekomendasi terhadap
pemeriksaan pre-transfusi khusus seperti pemeriksaan skirining dan identifikasi Ab pada
reaksi aloimunisasi, pemeriksaan terhadap Ab HLA untuk mencegah reaksi PTP atau
pemberian komponen darah khusus, seperti komponen darah yang diberikan sinar radiasi
untuk mencegah reaksi TA-GVHD. Pengetahuan dan latihan untuk mengenali gejala klinis
terhadap reaksi transfusi juga dapat dipakai untuk mencegah kemungkinan reaksi transfusi
pada pasien.
Topik 2
Reaksi Transfusi Non Imun
A. KONSEP DASAR
Reaksi transfusi non imun yang dimaksud di sini adalah reaksi yang tidak melibatkan
sistem imun (reaksi Ag dan Ab) secara langsung. Reaksi transfusi non imun lebih banyak
disebabkan oleh efek pemberian komponen darah yang berpengaruh terhadap metabolisme
tubuh, seperti penumpukan zat besi (Fe) di dalam tubuh pasien, maupun efek karena
penyimpanan komponen darah yang menghasilkan berbagai macam substan yang
mempengaruhi metabolisme tubuh. Berdasarkan waktu munculnya gejala klinis pada pasien,
reaksi transfusi non imun dapat bersifat akut maupun tunda. Reaksi transfusi non imun yang
bersifat akut termasuk kontaminasi bakteri, oversirkulasi darah, dan reaksi fisik serta kimia
terkait penyimpanan komponen darah. Reaksi non imun yang bersifat tunda , yaitu adanya
infeksi menular lewat transfusi darah seperti infeksi virus dan parasit (akan dibahas tersendiri
di bab 5) serta akumulasi Fe di dalam darah.
B. REAKSI TRANSFUSI NON IMUN AKUT
B.1 Sepsis karena kontaminasi bakteri di dalam kantong darah
Sepsis merupakan reaksi tubuh terhadap infeksi yang cukup berat, jika tidak tertangani
dengan baik, maka dapat terjadi kerusakan organ. Kontaminasi bakteri merupakan penyebab
utama terjadinya infeksi pada pasien paska transfusi. Berdasarkan beberapa studi, diketahui
bahwa resiko kontaminasi bakteri pada komponen darah lebih besar dibandingkan infeksi
menular lewat transfusi darah, seperti : HIV, hepatitis C (HCV), hepatitis B (HBV). Jenis
komponen darah yang sering terkontaminasi bakteri adalah komponen trombosit.
Kontaminasi biasanya berasal dari bakteri kontaminan yang berasal dari kulit lengan
donor pada saat pengambilan darah. Proses antisepsis kulit donor yang kurang baik
memicu bakteri yang normal ada di kulit donor dapat ikut bersama dengan aliran
darah ke dalam kantong darah.
Proses pengolahan komponen darah, juga rentan terhadap kontaminasi bakteri dalam
kantong darah donor. Pembuatan komponen darah yang tidak aseptik memungkinkan bakteri
dapat tumbuh dan memperbanyak diri di dalam kantong komponen darah. Pada pembuatan
komponen wash erythrocyte (WE) kemungkinan darah di dalam kantong dapat kontak dengan
udara luar dan memperbesar resiko kontaminasi bakteri. Oleh karena itu, masa simpan
komponen darah ini pendek.
Kontaminasi juga bisa terjadi pada proses penyimpanan komponen darah. Seperti
diketahui, komponen darah untuk transfusi disimpan dalam kisaran suhu yang beragam,
sebagai contoh : komponen trombosit yang disimpan pada suhu 22±20 C. Kondisi ini
memungkinkan bakteri dapat tumbuh dan memperbanyak diri. Selain itu, jenis kantong
komponen trombosit yang berpori, dapat meningkatkan kemungkinan kontaminasi bakteri
dari lingkungan sekitar. Oleh karena itu, masa penyimpanan trombosit maksimal adalah lima
hari. Selain itu, jika komponen darah yang disimpan pada suhu dingin, kemudian ditaruh di
suhu ruang lebih dari 30 menit, maka dapat meningkatkan reaksi kontaminasi bakteri.
Komponen sel darah merah juga dapat terkontaminasi oleh bakteri yang berasal dari
donor, akan tetapi tidak menimbulkan gejala klinis pada donor, sehingga tidak terdeteksi pada
saat seleksi donor. Sebagai contoh, bakteri Yersinia enterolitica yang tidak terlalu
menampakkan gejala klinis, yaitu donor hanya menderita diare ringan. Yersinia enterolitica,
diketahui juga dapat memproduksi toksin pada suhu rendah.
Beberapa jenis bakteri dapat tumbuh dan berkembang pada suhu dingin, sehingga
memungkinkan komponen sel darah merah, dengan suhu simpan 4±2O C dapat
terkontaminasi bakteri. Jenis bakteri yang dapat mengontaminasi yaitu : Bakteri batang Gram
negatif (Yersinia enterocolitica, E.coli, Enterobacter/Pantoea sp, Serratia marcescens dan
S.liquifaciens, Pseudomonas sp) dan bakteri kokus Gram positif (Staph. Epidermidis,
Propionibacteria, Staph aureus). Kontaminasi bakteri juga dapat mencetus sel lekosit yang
ada di dalam kantong darah untuk memproduksi sitokin yang dapat memicu efek demam pada
pasien.
Gejala klinis pasien yang diakibatkan karena kontaminasi bakteri, yaitu : demam
(kenaikan suhu dapat > 20 C), menggigil, mual, muntah, hipotensi dan dapat terjadi shock.
Gejala ini dapat terjadi beberapa menit pada saat transfusi. Jika reaksi sepsis terjadi pada
pasien transfusi, dengan gejala kenaikan suhu tubuh > 20 C dan hipotensi, maka komponen
darah yang ditransfusikan perlu diperiksa dengan pewarnaan Gram dan kultur bakteri. Sampel
pasien setelah transfusi juga dikultur, untuk mengetahui kesamaan dari jenis bakteri yang
ada pada masing-masing sampel.
B.2. Efek transfusi terhadap komponen darah simpan
Komponen darah yang disimpan dalam jangka waktu tertentu, akan memberikan reaksi
transfusi terhadap pasien. Faktor fisik sel darah maupun faktor kimia dari komponen darah
dapat mempengaruhi kualitas komponen darah simpan. Faktor fisik diantaranya adalah :
kerusakan sel darah terutama sel darah merah (hemolisis) pada proses pengolahan komponen
darah dan penyimpanan. Faktor kimia terkait dengan unsur kimia yang teraktivasi pada proses
pengolahan maupun komponen darah, sebagai contoh, kalium yang keluar dari dalam sel
darah ke plasma selama proses penyimpanan darah.
Selama penyimpanan komponen darah, perubahan-perubahan metabolik terjadi baik
di dalam sel darah maupun di plasma. Perubahan yang terjadi dapat mempengaruhi efek
terapi dan pengobatan yang diberikan. Pada proses penyimpanan komponen darah tidak ada
keseimbangan antara produksi dan destruksi, sintesis dan pemecahan protein, hanya ada
destruksi tanpa ada produksi s

.jpg)
.jpg)