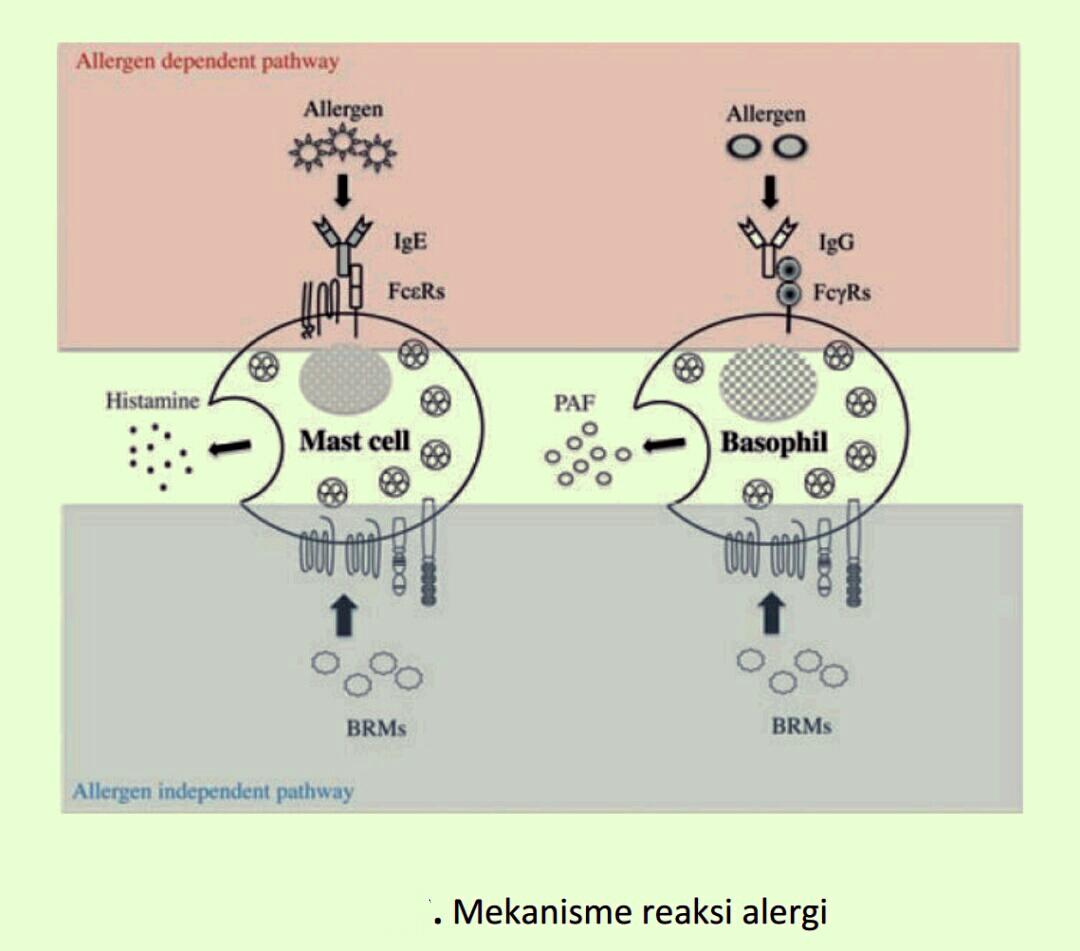
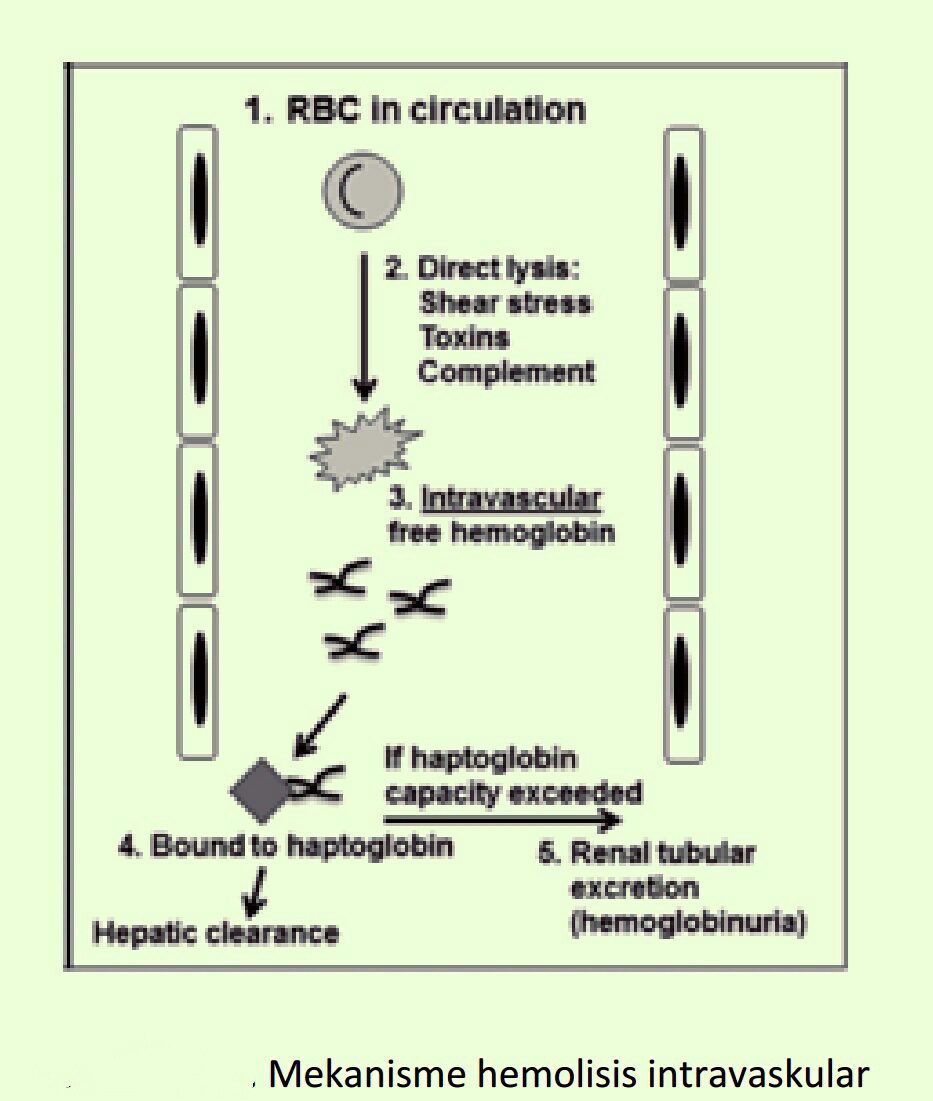
Home »
bank darah 3
» bank darah 3
bank darah 3
Juni 21, 2023
bank darah 3
penanda harus dihilangkan agar tidak dipakai untuk penggunaan klinis atau manufaktur.
7) Semua unit reaktif harus ditandai jelas (dilabel) dan dihilangkan dari stok karantina dan
disimpan secara terpisah dengan aman sampai unit dibuang atau disimpan untuk tujuan
jaminan kualitas atau penelitian sesuai dengan kebijakan nasional.
Pengujian konfirmasi darah yang reaktif harus dilakukan untuk pemberitahuan donor,
konseling dan rujukan untuk pengobatan, penangguhan atau recall untuk sumbangan masa
depan, dan melihat kembali donasi.
Alat tes yang paling umum dipakai dirancang untuk mendeteksi antibodi, antigen
atau asam nukleat dari agen infeksi. Namun, tidak semua tes cocok dalam segala situasi dan
setiap pemeriksaan memiliki keterbatasan yang perlu dipahami dan dipertimbangkan ketika
memilih pemeriksaan ini .
Jenis utama dari uji yang dipakai untuk skrining darah adalah:
1) Immunoassays (IAS):
- Enzim immunoassay (EIAs)
- Chemiluminescent immunoassays (CLIAs)
- Hemaglutinasi (HA) / Tes partikel aglutinasi (PA)
- Tes cepat / sederhana sekali pakai (Rapid Test)
2) Tes teknologi amplifikasi asam nukleat (NAT).
Dalam konteks skrining darah, evaluasi yang tepat diperlukan dalam memilih jenis tes
untuk setiap infeksi menular lewat transfusi darah, berdasarkan pentingnya karakteristik
pemeriksaan, seperti sensitivitas dan spesifisitas, serta biaya dan kemudahan penggunaan.
-- Immunoassays (IAS)
Immunoassays adalah sistem uji yang tersedia dalam beberapa format yang dapat
dipakai untuk mendeteksi antibodi, antigen atau kombinasi dari keduanya. Umumnya, tes
yang paling sederhana untuk deteksi antibodi didasarkan pada penggunaan antigen amobil
(fase diam) yang menangkap setiap antibodi spesifik yang ada dalam sampel uji (IA tidak
langsung/indirect). Umumnya tes deteksi antigen dipakai didasarkan pada penggunaan
antibodi bergerak ke menangkap antigen patogen spesifik hadir dalam sampel.
Immunoassays dapat dipakai dalam situasi yang berbeda dari laboratorium dengan
otomatisasi penuh atau untuk laboratorium menengah dengan semi-otomasi, dan juga
laboratorium kecil, seperti di daerah-daerah terpencil yang melakukan sejumlah tes secara
manual.
2.3.2 Enzim immunoassay (EIAs) dan Immunoassays Chemiluminescent (CLIAs)
Enzim immunoassay (EIAs) dan Immunoassays Chemiluminescent (CLIAs) adalah tes
yang paling umum dipakai untuk skrining IMLTD darah donor . Desain EIAs dan CLIAs mirip
dan mereka hanya berbeda dalam cara deteksi kompleks imun dalam pembentukan
kompleks warna dalam EIAs dan pengukuran cahaya yang dihasilkan oleh reaksi bahan kimia
di CLIAs. Salah satu jenis dari pemeriksaan imunoserologi (Immunoassay/IA) dengan
sensitivitas tinggi, pada biasanya diperlukan mendeteksi penanda target infeksi dan harus
dievaluasi dengan benar untuk skrining darah serta menjaga kualitas mutu hasil pemeriksaan.
EIAs dan CLIAs cocok untuk jumlah besar sampel dan membutuhkan berbagai peralatan
khusus. Tes ini dapat dilakukan baik non manual atau sistem pengolahan uji otomatis (sistem
terbuka) dan sistem otomatis (sistem tertutup). EIAs dan CLIAs memiliki fase padat yang
berbeda untuk menangkap antigen atau antibodi. Paling umum, fase padat yang dipakai
adalah:
1) Dasar dan sisi dari microwell polystyrene
2) Permukaan polystyrene atau bahan lainnya
3) Micro-partikel
4) Permukaan perangkat pakai tertentu yang dipakai dalam sistem otomatis biasanya
polystyrene
5) Strips dari nilon atau membran nitro-selulosa, khusus dipakai di Western Blot dan line
assay.
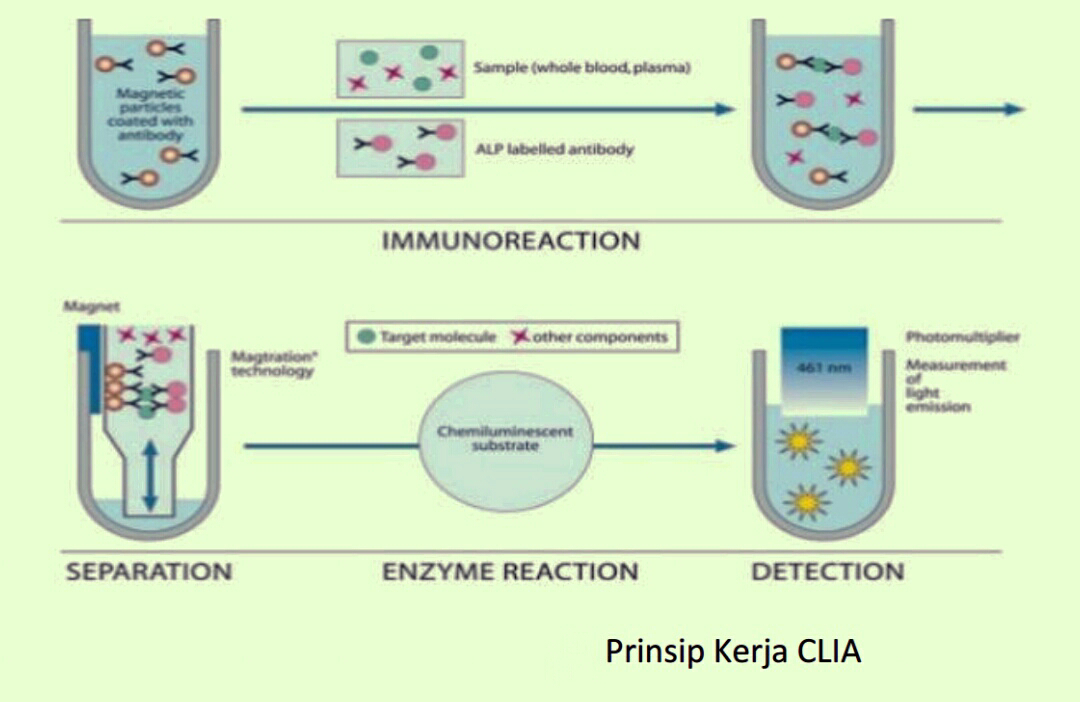
Gambar Prinsip Kerja CLIA
Pada gambar prinsip kerja CLIA ke dalam well dimasukkan antibodi yang dicoated
dengan partikel magnetic, kemudian ditambahkan sampel yang mengandung target antigen
dan ditambahkan juga antibodi yang dilabel ALP. Inkubasi untuk terjadi reaksi imulogi.
Kemudian dipisahkan komponen yang tidak dibutuhkan dengan teknologi magnetisasi dan
kemudian ditambahkan substrat akridium ester yang mengakibatkan reaksi enzimatis dan
kemudian pendaran di deteksi dengan luminometer dengan panjang gelombang 461 nm.
Gambar. Prinsip Kerja ELISA/EIA
menunjukkan ke dalam well dilekatkan (coated) antibodi spesifik, kemudian
ditambahkan sampel yang mengandung target antigen dan dilakukan pencucian untuk
menghilangkan analit yang tidak bereaksi. Ditambahkan juga antibodi kedua yang dilabel
enzim dan kemudian ditambahkan substrat dan stop solution, maka akan terjadi perubahan
warna. Perubahan warna yang terbentuk diukur dengan fotometer dengan panjang
gelombang tertentu. Hasil reaktif jika nilai absorban > dari nilai cut off.
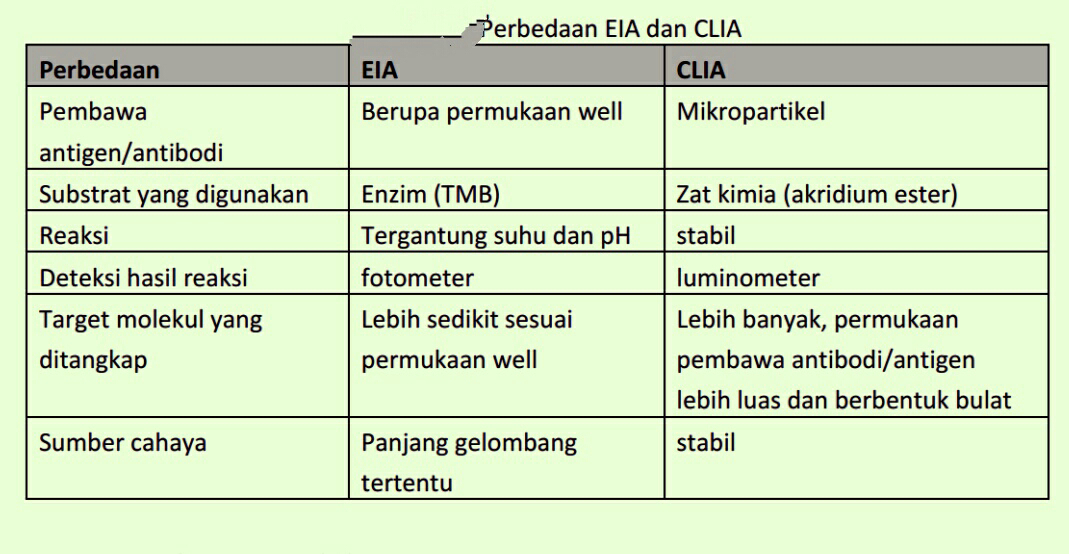
Berikut ini adalah perbedaan EIA dan CLIA berdasarkan tabel 18 di bawah ini.
Tabel 17. Perbedaan EIA dan CLIA
Perbedaan EIA CLIA
Pembawa
antigen/antibodi
Berupa permukaan well Mikropartikel
Substrat yang dipakai Enzim (TMB) Zat kimia (akridium ester)
Reaksi Tergantung suhu dan pH stabil
Deteksi hasil reaksi fotometer luminometer
Target molekul yang
ditangkap
Lebih sedikit sesuai
permukaan well
Lebih banyak, permukaan
pembawa antibodi/antigen
lebih luas dan berbentuk bulat
Sumber cahaya Panjang gelombang
tertentu
stabil
2.3.3 Tes aglutinasi partikel
Tes aglutinasi partikel mendeteksi keberadaan antibodi spesifik atau antigen di sampel
uji melalui aglutinasi partikel dilapisi dengan komplemen antigen tertentu atau antibodi
masing-masing. Tes aglutinasi, terutama tes antibodi menggunakan berbagai partikel
termasuk sel darah merah (haemagglutination) dan partikel inert seperti gelatin dan lateks.
Penggunaan partikel ini memiliki keuntungan mengurangi reaktivitas non-spesifik terhadap
reaksi silang antigen sel darah merah. Prinsip-prinsip dasar haemagglutination dan tes
partikel aglutinasi adalah sama, terlepas dari jenis partikel bebas. Tes aglutinasi partikel
masih dipakai secara luas untuk mendeteksi antibodi sifilis. aglutinasi partikel tidak
melibatkan beberapa langkah atau pencucian peralatan.
Gambar Prinsip Tes Partikel Aglutinasi
Pada gambar 5.3 menunjukkan antibodi spesifik dilapisi dengan partikel lateks, kemudian
ditambahkan serum atau plasma yang mengandung antigen maka akan terbentuk aglutinasi
yang dapat diamati langsung dengan bantuan partikel lateks ini . Hasil reaktif jika terjadi
aglutinasi.
2.3.4 Rapid Test
Rapid Test dipakai sekali dan dibuang. Banyak tes cepat didasarkan pada bentuk
imunokromatografi dimana sampel ditambahkan mengalir turun strip inert dan bereaksi
dengan sebelumnya reagen dengan fase gerak. Sampel bisa serum, plasma atau bahkan darah
lengkap dalam beberapa kasus. Reaksi positif divisualisasikan sebagai titik atau garis / band
yang muncul di strip. Sebagian besar tes juga mengharuskan timbulnya garis / band pada
daerah kontrol yang dipakai untuk memvalidasi hasil masing-masing perangkat.
Gambar . Prinsip Kerja Rapid Test
Gambar menggambarkan antibodi spesifik yang dicoated konjugat emas dilapiskan
pada membran selulosa, kemudian ditambahkan serum atau plasma yang mengandung
antigen maka akan terjadi ikatan antigen-antibodi+konjugat emas yang akan bergerak ke
daerah tes yang telah dilekatkan antibody spesifik kedua dan akan terbentu warna di bagian
test. Sisa antibodi spesifik yang dicoated konjugat emas akan terus bererak ke bagian kontrol
dan akan ditangkap oleh anti IgG sehingga terbentuk pita di bagian Kontrol.
Di bawah ini pada tabel 5.2 menjelaskan perbedaan EIA dan Rapid Tes, yaitu
Tabel 5.2. Perbedaan EIA dan Rapid Test
Perbedaan EIA Rapid Tes
Penggunaan Lebih banyak langkah Mudah
Waktu Lama Cepat
Spesifisitas Bisa terjadi false positif Lebih tinggi dari EIA
Sensitivitas Tinggi Lebih rendah dari EIA
Cara deteksi Menggunakan fotometer Pengamatan langsung
-- Tes Teknologi Amplifikasi Asam Nukleat
Teknologi amplifikasi asam nukleat (NAT), seperti yang diterapkan untuk skrining darah,
mendeteksi keberadaan asam nukleat virus berbentuk DNA atau RNA dalam darah donor.
Dalam teknologi ini, segmen RNA / DNA spesifik virus ditargetkan dan diperkuat secara in-
vitro. Langkah amplifikasi memungkinkan dapat mendeteksi titer virus yang rendah dalam
sampel asli dengan meningkatkan jumlah yang target yang hadir spesifik untuk titer yang
mudah dideteksi. Kehadiran asam nukleat spesifik menunjukkan kehadiran virus itu sendiri
dan bahwa sumbangan ini mungkin menular.
Pada gambar menunjukkan pada prinsip kerja NAT RNA atau DNA virus di amplifikasi
dengan bantuan enzim reverse trankriptase untuk mendapatkan DNA virus atau agen infeksi
murni. Tes NAT baik dapat dilakukan pada donor pasien (ID) atau mini-pool (MP) untuk
mendeteksi asam nukleat dari agen infeksi. Selain tes NAT yang menargetkan asam nukleat
virus, multipleks tes skrining NAT yang dikembangkan dapat mendeteksi DNA atau RNA dari
beberapa virus secara bersamaan.
Topik 1
HEPATITIS B
A. STRUKTUR DAN MORFOLOGI
Hepatitis B merupakan suatu penyakit hati yang disebabkan oleh virus Hepatitis B, yaitu
salah satu virus termasuk anggota famili hepadnavirus yang dapat memicu peradangan
hati akut atau kronis yang dapat berlanjut menjadi sirosis hati atau kanker hati. Hepatitis B
akut jika perjalanan penyakit kurang dari 6 bulan sedangkan Hepatitis B kronis bila penyakit
menetap, tidak menyembuh secara klinis atau laboratorium atau pada gambaran patologi
anatomi selama 6 bulan.
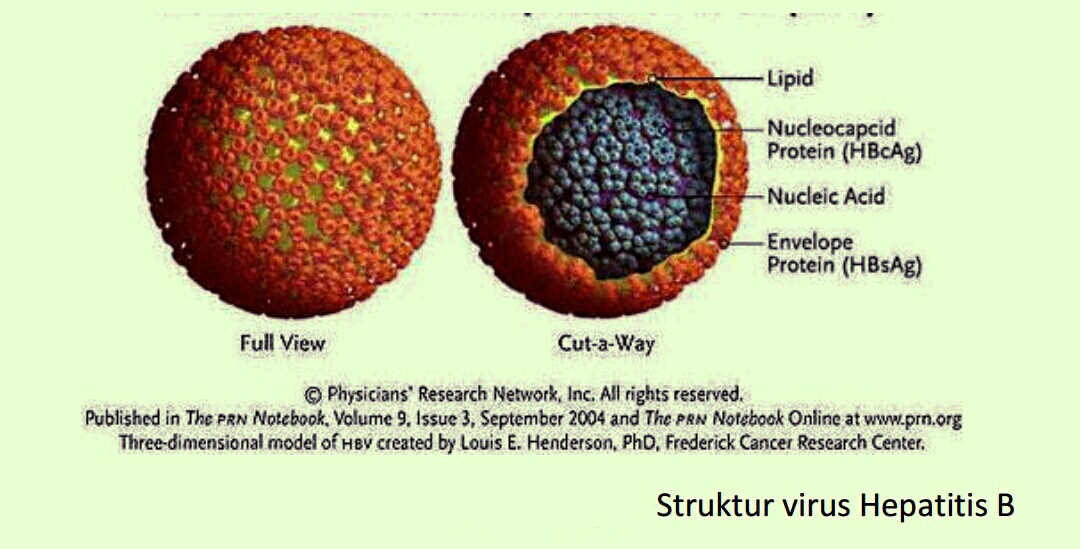
Gambar Struktur virus Hepatitis B
Virus Hepatitis B (VHB) adalah virus (Deoxyribo Nucleic Acid) DNA terkecil berasal dari
genus Orthohepadnavirus famili Hepadnaviridae berdiameter 40-42 nm. Masa inkubasi
berkisar antara 15-180 hari dengan rata-rata inkubasi 60-90 hari. Bagian luar dari virus ini
adalah protein envelope lipoprotein, sedangkan bagian dalam berupa nukleokapsid atau core.
Genom virus hepatitis B merupakan molekul DNA sirkular untai-ganda parsial dengan 3200
nukleotida . Genom berbentuk sirkuler dan memiliki empat Open Reading Frame (ORF) yang
saling tumpang tindih secara parsial protein envelope yang dikenal sebagai selubung HBsAg
seperti large HBs (LHBs), medium HBs (MHBs), dan small HBs (SHBs) disebut gen S, yang
merupakan target utama respon imun host, dengan lokasi utama pada asam amino 100-160.
HBsAg dapat mengandung satu dari sejumlah subtipe antigen spesifik, disebut d atau y, w atau
r. Subtipe HbsAg ini menyediakan penanda epidemiologik tambahan. Gen C yang mengkode
protein inti (HBcAg) dan HBeAg, gen P yang mengkode enzim polimerase yang dipakai
untuk replikasi virus, dan terakhir gen X yang mengkode protein X (HBx), yang memodulasi
sinyal sel host secara langsung dan tidak langsung mempengaruhi ekspresi gen virus ataupun
host, dan belakangan ini diketahui berkaitan dengan terjadinya kanker hati.
Gambar . Genom virus Hepatitis B
Infeksi VHB merupakan penyebab utama hepatitis akut, hepatitis kronis, sirosis, dan
kanker hati di dunia. Infeksi ini endemis di daerah Timur Jauh, sebagian besar kepulaan Pasifik,
banyak negara di Afrika, sebagian Timur Tengah, dan di lembah Amazon. Center for Disease
Control and Prevention (CDC) memperkirakan bahwa sejumlah 200.000 hingga 300.000 orang
(terutama dewasa muda) terinfeksi oleh VHB setiap tahunnya. Hanya 25% dari mereka yang
mengalami ikterus, 10.000 kasus memerlukan perawatan di rumah sakit, dan sekitar 1-2%
meninggal.
Sepertiga penduduk dunia diperkirakan telah terinfeksi oleh VHB dan sekitar 400 juta
orang merupakan pengidap kronik Hepatitis B, sedangkan prevalensi di Indonesia dilaporkan
berkisar antara 3-17%. Virus Hepatitis B diperkirakan telah menginfeksi lebih dari 2 milyar
orang yang hidup saat ini selama kehidupan mereka. Tujuh puluh lima persen dari semua
pembawa kronis hidup di Asia dan pesisir Pasifik Barat. Prevalensi pengidap VHB tertinggi ada
di Afrika dan Asia. Hasil Riset Kesehatan Dasar tahun 2007 menunjukkan bahwa Hepatitis klinis
terdeteksi di seluruh provinsi di Indonesia dengan prevalensi sebesar 0,6% (rentang: 0,2%-
1,9%). Hasil Riskesdas Biomedis tahun 2007 dengan jumlah sampel 10.391 orang
menunjukkan bahwa persentase HBsAg positif 9,4%. Persentase Hepatitis B tertinggi pada
kelompok umur 45- 49 tahun (11,92%), umur >60 tahun (10.57%) dan umur 10-14 tahun
(10,02%), selanjutnya HBsAg positif pada kelompok laki-laki dan perempuan hampir sama
(9,7% dan 9,3%). Hal ini menunjukkan bahwa 1 dari 10 penduduk Indonesia telah terinfeksi
virus Hepatitis B.
B. CARA PENULARAN
Penularan virus hepatitis B (VHB) adalah melalui parenteral dan menembus membran
mukosa, terutama berhubungan seksual. Penanda HBsAg telah diidentifikasi pada hampir
setiap cairan tubuh dari orang yang terinfeksi yaitu saliva, air mata, cairan seminal, cairan
serebrospinal, asites, dan air susu ibu. Beberapa cairan tubuh ini (terutama semen dan saliva)
telah diketahui infeksius dan dapat menularkan virus VHB.
Jalur penularan infeksi VHB yang terbanyak di Indonesia adalah secara parenteral yaitu
secara vertikal (transmisi) mateRNAl-neonatal atau horisontal (kontak antar pasien yang
sangat erat dan lama, seksual, infeksi nosokomial akibat prosedur diagnostik (iatrogenik),
penggunaan jarum suntik bersama). Virus Hepatitis B dapat dideteksi pada semua sekret dan
cairan tubuh manusia, dengan konsentrasi tertinggi pada serum.
Infeksi VHB berlangsung dalam dua fase. Selama fase proliferatif, DNA VHB ada
dalam bentuk episomal, dengan pembentukan virion lengkap dan semua antigen terkait.
Ekspresi gen HBsAg dan HBcAg di permukaan sel disertai dengan molekul MHC kelas I
memicu pengaktifan limfosit T sitotoksik (CD8+). Selama fase integratif, DNA virus
meyatu kedalam genom pejamu. Seiring dengan berhentinya replikasi virus dan munculnya
antibodi virus, infektivitas berhenti dan kerusakan hati mereda. Namun risiko terjadinya
karsinoma hepatoselular menetap. Hal ini sebagian disebabkan oleh disregulasi pertumbuhan
yang diperantarai protein X VHB. Kerusakan hepatosit terjadi akibat kerusakan sel yang
terinfeksi virus oleh sel sitotoksik (CD8+).
Gambar . Patogenesis imun pada virus hepatitis B
Proses replikasi VHB berlangsung cepat, sekitar 1010-1012 virion dihasilkan setiap hari.
Siklus hidup VHB dimulai dengan menempelnya virion pada reseptor di permukaan sel hati
). Setelah terjadi fusi membran, partikel core kemudian ditransfer ke sitosol dan
selanjutnya dilepaskan ke dalam nucleus (genom release), selanjutnya DNA VHB yang masuk
ke dalam nukleus mula-mula berupa untai DNA yang tidak sama panjang yang kemudian akan
terjadi proses DNA repair berupa memanjangnya rantai DNA yang pendek sehingga menjadi
dua untai DNA yang sama panjang atau covalently closed circle DNA (cccDNA).
Gambar Siklus replikasi virus hepatitis B (
Proses selanjutnya adalah transkripsi cccDNA menjadi pre-genom RNA dan beberapa
messenger RNA (mRNA) yaitu mRNA, LHBs, MHBs, dan mRNA SHBs. Semua RNA VHB
kemudian ditransfer ke sitoplasma dimana proses translasi menghasilkan protein envelope,
core, polimerase, polipeptida X dan pre-C, sedangkan translasi mRNA LHBs, MHBs, dan mRNA
SHBs akan menghasilkan protein LHBs, MHBs, dan SHBs. Proses selanjutnya adalah
pembuatan nukleokapsid di sitosol yang melibatkan proses encapsidation yaitu
penggabungan molekul RNA ke dalam HBsAg. Proses reverse transcription dimulai, DNA virus
dibentuk kembali dari molekul RNA. Beberapa core yang mengandung genom matang
ditransfer kembali ke nukleus yang dapat dikonversi kembali menjadi cccDNA untuk
mempertahankan cadangan template transkripsi intranukleus. Akan tetapi, sebagian dari
protein core ini bergabung ke kompleks golgi yang membawa protein envelope virus. Protein
core memperoleh envelope lipoprotein yang mengandung antigen surface L, M, dan S, yang
selanjutnya ditransfer ke luar sel.
Sel hati manusia merupakan target organ bagi virus Hepatitis B. Virus Hepatitis B mula-
mula melekat pada reseptor spesifik di membran sel hepar kemudian mengalami penetrasi ke
dalam sitoplasma sel hepar. Virus melepaskan mantelnya di sitoplasma, sehingga melepaskan
nukleokapsid. Selanjutnya nukleokapsid akan menembus sel dinding hati. Asam nukleat VHB
akan keluar dari nukleokapsid dan akan menempel pada DNA hospes dan berintegrasi pada
DNA ini . Proses selanjutnya adalah 17 DNA VHB memerintahkan sel hati untuk
membentuk protein bagi virus baru. Virus Hepatitis B dilepaskan ke peredaran darah, terjadi
mekanisme kerusakan hati yang kronis disebabkan karena respon imunologik penderita
terhadap infeksi.
Proses replikasi virus tidak secara langsung bersifat toksik terhadap sel, terbukti banyak
carrier VHB asimtomatik dan hanya memicu kerusakan hati ringan. Respon imun host
terhadap antigen virus merupakan faktor penting terhadap kerusakan hepatoseluler dan
proses klirens virus, makin lengkap respon imun, makin besar klirens virus dan semakin berat
kerusakan sel hati. Respon imun host dimediasi oleh respon seluler terhadap epitop protein
VHB, terutama HBsAg yang ditransfer ke permukaan sel hati. Human Leukocyte Antigen (HLA)
class I-restricted CD8+ cell yang mengenali fragmen peptida VHB setelah mengalami proses
intrasel dan dipresentasikan ke permukaan sel hati oleh molekul Major Histocompability
Complex (MHC) kelas I. Proses berakhir dengan penghancuran sel secara langsung oleh
Limfosit T sitotoksik (CD8+).
C. GEJALA KLINIS
Manifestasi klinis infeksi VHB pada pasien hepatitis akut cenderung ringan. Hepatitis B
sulit dikenali karena gejala-gejalanya tidak langsung terasa dan bahkan ada yang sama sekali
tidak muncul. sebab itulah, banyak orang yang tidak menyadari bahwa dirinya telah
terinfeksi. Virus ini biasanya berkembang selama 1-5 bulan sejak terjadi pajanan terhadap
virus sampai kemunculan gejala pertama. Kondisi asimtomatis ini terbukti dari tingginya
angka pengidap tanpa adanya riwayat hepatitis akut. Apabila menimbulkan gejala hepatitis,
gejalanya menyerupai hepatitis virus yang lain tetapi dengan intensitas yang lebih berat.
Beberapa gejala umum hepatitis B antara lain :
− Kehilangan nafsu makan.
− Mual dan muntah.
− Nyeri di perut bagian bawah.
− Sakit kuning (dilihat dari kulit dan bagian putih mata yang menguning).
− Gejala yang mirip pilek, misalnya lelah, nyeri pada tubuh, dan sakit kepala.
Gejala hepatitis akut terbagi dalam 4 tahap, yaitu:
1) Fase Inkubasi
Merupakan waktu antara masuknya virus dan timbulnya gejala atau ikterus. Fase inkubasi
Hepatitis B berkisar antara 15-180 hari dengan rata-rata INKUBASI 60-90 hari.
2) Fase prodromal (pra ikterik)
Fase diantara timbulnya keluhan-keluhan pertama dan timbulnya gejala ikterus.
Awitannya singkat atau insidous ditandai dengan malaise umum, mialgia, artalgia, mudah
lelah, gejala saluran napas atas dan anoreksia. Diare atau konstipasi dapat terjadi. Nyeri
abdomen biasanya ringan dan menetap di kuadran kanan atas atau epigastrum, kadang
diperberat dengan aktivitas akan tetapi jarang menimbulkan kolestitis.
3) Fase ikterus
Ikterus muncul setelah 5-10 hari, tetapi dapat juga muncul bersamaan dengan munculnya
gejala. Banyak kasus pada fase ikterus tidak terdeteksi. Setelah timbul ikterus jarang
terjadi perburukan gejala prodromal, tetapi justru akan terjadi perbaikan klinis yang
nyata.
4) Fase konvalesen (penyembuhan)
Diawali dengan menghilangnya ikterus dan keluhan lain, tetapi hepatomegali dan
abnormalitas fungsi hati tetap ada. Muncul perasaan sudah lebih sehat dan kembalinya
nafsu makan. Sekitar 5-10% kasus perjalanan klinisnya mungkin lebih sulit ditangani,
hanya <1% yang menjadi fulminan ,
Hepatitis B kronis didefinisikan sebagai peradangan hati yang berlanjut lebih dari enam
bulan sejak timbul keluhan dan gejala penyakit. Perjalanan hepatitis B kronik dibagi menjadi
tiga fase penting yaitu :
1) Fase Imunotoleransi
Sistem imun tubuh toleren terhadap VHB sehingga konsentrasi virus tinggi dalam darah,
tetapi tidak terjadi peradangan hati yang berarti. Virus Hepatitis B berada dalam fase
replikatif dengan titer HBsAg yang sangat tinggi.
2) Fase Imunoaktif (Clearance)
Sekitar 30% pasien persisten dengan VHB akibat terjadinya replikasi virus yang
berkepanjangan, terjadi proses nekroinflamasi yang tampak dari kenaikan konsentrasi
ALT. Fase clearance menandakan pasien sudah mulai kehilangan toleransi imun terhadap
VHB.
3) Fase Residual
Tubuh berusaha menghancurkan virus dan menimbulkan pecahnya sel-sel hati yang
terinfeksi VHB. Sekitar 70% dari pasien ini akhirnya dapat menghilangkan sebagian
besar partikel virus tanpa ada kerusakan sel hati yang berarti. Fase residual ditandai
dengan titer HBsAg rendah, HBeAg yang menjadi negatif dan anti-HBe yang menjadi
positif, serta konsentrasi ALT normal.
D. METODE PEMERIKSAAN
Virus Hepatitis B ada dalam aliran darah dengan titer virus itu sendiri bervariasi.
Dalam orang yang baru terinfeksi, DNA virus biasanya terdeteksi meskipun tidak selalu pada
titer tinggi. Pada pasien kronis, bila ditemukan DNA virus hepatitis B maka darah donor
ini infeksius atau jika tidak ditemukan DNA virus dan viremia dengan titer sangat rendah
atau tidak ada sama sekali, maka darah donor ini tidak infeksius.
Skrining untuk antigen permukaan hepatitis B (HBsAg) menunjukkan infeksi dengan
VHB, tetapi tidak dengan sendirinya membedakan antara infeksi baru dan kronis. Perbedaan
antara infeksi akut dan kronis tidak relevan dengan penyaringan darah, semua sumbangan
HBsAg positif harus dianggap berisiko tinggi transmisi VHB dan tidak akan dikeluarkan untuk
transfusi. Beberapa penelitian menunjukkan ketika HBsAg negatif pada beberapa pasien
dengan titer DNA virus rendah yang terdeteksi oleh Nucleic Acid Test (NAT), maka darah
ini dapat memicu infeksi pada resipien / penerima. Infeksi kemudian memiliki
probabilitas yang lebih tinggi untuk maju ke sirosis dan karsinoma hepatoseluler.
Serologi virus hepatitis B adalah kompleks. Sejumlah tanda serologi yang berbeda
mengembangkan selama infeksi, termasuk antigen permukaan hepatitis B (HBsAg) dan
antibodi hepatitis B inti (anti-HBc). Metode yang dipakai untuk mengidentifikasi
keberadaan VHB menggunakan target skrining berikut:
-- Metode serologis:
− Antigen permukaan Hepatitis B (HBsAg) : 3 minggu setelah infeksi.
− Hepatitis B inti (Hbc) antibodi ( anti-HBs dengan titer ≥ 100 mIU/mL, maka dianggap
aman)
-- Asam nukleat virus: HBV DNA.
Untuk meminimalkan risiko infeksi penularan virus hepatitis B melalui transfusi, maka
direkomendasikan oleh WHO sebagai berikut :
1) Skrining harus dilakukan dengan menggunakan sangat sensitif dan spesifik yaitu HBsAg
immunoassay (EIA / CLIA).
2) Skrining menggunakan HBsAg rapid test yang sangat sensitif dan spesifik atau
pemeriksaan partikel aglutinasi dapat dilakukan di laboratorium yang kecil, di daerah
terpencil atau dalam situasi darurat.
3) Skrining untuk anti-HBc tidak dianjurkan sebagai rutinitas. Negara harus menentukan
kebutuhan untuk skrining anti-HBc berdasarkan prevalensi dan kejadian infeksi HBV.
4) Skrining untuk ALT tidak dianjurkan.
Pemeriksaaan HBsAg metode rapid Test
Prinsip pemeriksaan :
HBsAg dalam sampel akan berikatan dengan anti-HBs colloidal
gold konjugat membentuk komplek yang akan bergerak melalui membran area tes
yang telah dilapisi oleh anti-HBsAg. Kemudian terjadi reaksi membentuk garis berwarna
merah muda keunguan yang menunjukkan hasil positif pada area tes. Apabila dalam
sampel tidak ada HBsAg maka tidak akan menimbulkan garis merah pada area tes.
Kelebihan anti-HBs colloidal gold konjugat akan terus bergerak menuju area kontrol (C)
yang telah dilapisi anti IgG tikus dari serum kambing (anti-mouse IgG antibody), sehingga
berikatan dan membentuk garis merah pada area kontrol yang menunjukkan hasil
pemeriksaan valid.
Cara kerja :
1) Disiapkan alat dan bahan yang akan dipakai .
2) Dilakukan pengambilan sampel.
3) Dimasukan darah kedalam tabung reaksi, diamkan selama 30 menit, kemudian di
sentrifus selama 15 menit dengan kecepatan 3000 rpm.
4) Serum/plasma terbentuk kemudian dipindahkan ke tabung kosong lainnya
5) Celupkan reagen strip kedalam tabung yg telah di isi sampel tadi sampai tanda batas
pada strip,biarkan selama 15 menit.
6) Pengamatan hasil tidak boleh dibaca lebih dari 20 menit.
interpretasi Hasil :
− Positif (+)
Selain timbul garis merah pada daerah control (C), akan muncul 1 (satu) garis merah
yang nyata di daerah test (T), hasil positif menyatakan adanya HBsAg.
− Negatif (-)
Timbul 1 (satu) garis merah pada bagian kontrol (C), dan tidak ada garis merah di
daerah test (T).
− Invalid
Sama sekali tidak muncul warna merah baik pada daerah test (T), maupun kontrol
(C), merupakan adanya indikasi adanya kesalahan prosedur atau reagen test yang
rusak.
Pemeriksaaan HBsAg metode ELISA / CHLIA
Gambar Prinsip Pemeriksaan HBsAg Metode ELISA
Prinsip pemeriksaan : Antibodi ganda “sandwich” imunosai yang menggunakan
antibodi anti-HBsAg spesifik: antibodi monklonal HBsAg yang berada di dasar sumur
mikrotiter dan antibodi poliklonal HBsAg ditambahkan dengan Horseradish Peroxidase
(HRP) sebagai larutan konjugat. Selama pemeriksaan, adanya HBsAg dalam spesimen
akan bereaksi dengan antibodi-antibodi ini untuk membentuk kompleks imun
“antibodi-HBsAg-antibodi- HRP”. Setelah materi yang tidak terikat tercuci selama
pemeriksaan, substrat ditambahkan untuk menunjukkan hasil tes. Munculnya waRNA
biru di sumur mikrotiter mengindikasikan HBsAg reaktif. Tidak adanya waRNA
menunjukkan hasil non reaktif di spesimen
Alat dan Bahan :
- Alat
1. Mikrotiter well
2. Mikropipet
3. Tip Kuning dan Tip Biru
4. Inkubator
5. ELISA Reader
6. ELISA Washer
- Reagen
1. Enzim Konjugat
2. Kontrol Positif
3. Kontrol Negatif
4. Sampel diluent
5. Color A dan B
6. Stop Solution
7. Wash Buffer
- Sampel serum pasien
1
Cara Kerja :
a. Pembuatan Wash Buffer
1. Wash buffer pekat dicampurkan dengan aquadest perbandingan (1:19)
2. Campuran yang sudah jadi disimpan pada suhu ruang selama seminggu
b. Prosedur Pemeriksaan
1) Semua reagen dan specimen dikondisikan pada suhu ruang.
2) Siapkan nomor yang dibutuhkan untuk sumur, yang terdiri dari 1 sumur blanko, 2
sumur control positif, 2 sumur untuk control negatif dan 1 sumur untuk setiap
specimen. Tulis nomor seri untuk control dan specimen pada kolom.
3) Spesimen diluents ditambahkan sebanyak 20µl pada masing-masing sumur.
4) Spesimen, control negative, control positif ditambahkan sebanyak 100µl sesuai
dengan kolom data. (sediakan 1 sumur untuk blanko)
5) Kemudian dihomogenkan
6) Plate diinkubasi pada incubator suhu 37°C ± 1 jam
7) Enzyme conjugate ditambahkan pada setiap sumur ± 50µl.
8) Plate diinkubasi pada incubator suhu 37°C ± 30 menit.
9) Setiap sumur dicuci dengan wash buffer dengan prosedur :
-- Pencucian yang dilakukan harus sesuai dengan petunjuk apabila ada
pencucian yang tidak sempuRNA maka akan mempengaruhi hasil.
-- Semua isi sumur dimasukkan pada labu cuci. Kemudian ditambahkan wash buffer
350/lebih.
-- Pastikan tidak ada cairan di dalam tip dan setelah pemipetan terakhir.
10) Color A & B dimasukkan pada setiap sumur sebanyak 50µl
11) Plate diinkubasi pada waterbath/inkubator 37° C± 30 menit
12) Hentikan reaksi dengan penambahan 50µl stopping solotion disetiap sumur
13) Absorbansi setiap sumur dibaca pada 450nm & 630nm λ λ
14) Perhitungan
- Single wave length (λ=450nm)
OD = OD450 ±ODBC450
= sampel – control
- Dual wave length (λ=630nm)
Hasil pemeriksaan valid jika :
1) Nilai OD blanko kurang dari 0.100 ( sumur dari kontrol blanko hanya berisi
kromogen dan stop solution)
2) Nilai OD kontro negatif harus sama atau kurang dari () 0.100. Dieliminasi kontrol negatif
dengan nilai OD lebih besar dari () 0.100. Jika 2 nilai keluar dari batas, pemeriksaan
invalid dan harus di ulangi.
3) Nilai OD kontrol positif sama atau lebih besar () 0.500. Jika nilai OD kurang dari 0.500,
pemeriksaan invalid dan harus di ulangi
Perhitungan kontrol :
Nilai cut-off (CO) = NCx . 2,1
NCx : nilai absorbansi rata-rata kontrol negative (jika NCx 0.05 , NCx harus dihitung 0.05)
Interpretasi hasil :
1) Spesimen dengan absorbansi kurang dari (<) nilai cut-off dinyatakan negatif.
2) Spesimen dengan nilai absorbansi lebih besar atau sama dengan () nilai cut-off
dinyatakan positif.
Topik 2
Human Immunodeficiency Virus (HIV)
A. STRUKTUR DAN MORFOLOGI
Sejarah HIV dimulai pada tahun 1981 di Amerika Serikat melaporkan kasus Gay Related
Immune Deficiency (GRID), yaitu penurunan kekebalan tubuh yang dihubungkan dengan kaum
gay/homoseksual. Pada tahun 1982 , CD–USA (Centers for Disease Control) Amerika Serikat
untuk pertama kali membuat definisi AIDS dan juga ditemukan penyebab kelainan ini adalah
LAV (Lymphadenophaty Associated Virus) oleh Luc Montagnier dari Pasteur Institut Paris.
Tahun 1983, Jean Claude Chermann dan Françoise Barré-Sinnousi melakukan isolasi dari
penderita sindrom limfadenopati. Tahun 1984, Robert Gallo dari Amerika Serikat, meneliti
virus penyebab AIDS yaitu HTLV-III. Tahun 1986, InteRNAtional Committe on Taxonomi of
Viruses, memutuskan nama penyebab penyakit AIDS adalah Human Immunodeficiency Virus
(HIV) yang mengganti nama LAV dan HTLV III. Pada tanggal 15 April 1987, pertama kali AIDS
di Indonesia yaitu pasien beRNAma Edward Hop berumur 44 tahun dari Belanda, meninggal
di Rumah Sakit Sanglah Bali dan pada akhir tahun 1987 ada 6 orang yang didiagnosis HIV
positif, dua di antara mereka mengidap AIDS.
HIV (Human Immunodeficiency Virus) merupakan suatu retrovirus dengan materi
genetik (RNA) yang dapat mentransfer informasi genetik RNA ke DNA dengan menggunakan
enzim yang disebut reverse transcriptase. HIV menginfeksi berbagai sel sistem imun antara
lain : Sel T helper (CD4+), Makrofag dan sel dendritik. Infeksi HIV memicu penurunan
kekebalan tubuh yang berhubungan dengan infeksi oportunistik dan tumor ganas disebut
AIDS (Acquired Immunodeficiency Syndrome). Virus HIV dibagi dua tipe, yaitu : HIV-1 dan HIV-
2. HIV-1 lebih cepat memicu AIDS dan bersifat akut, sedangkan HIV-2 memicu
AIDS lebih lambat dan bersifat kronik. Menurut data WHO 2010, angka kejadian HIV dari 119
negara secara global menurut mencapai 35.000.000 orang terinfeksi HIV (sekitar 33.200.000-
37.200.000 orang) dan 15.000.000 0rang meninggal .
Struktur HIV-1 (gambar 5.6.), diameter virion mencapai 100 nm, tersusun dari dua strand
RNA yang identik (viral genom) dengan panjang 9749 nukleotida yang mengkode bermacam-
macam enzim diantaranya enzim reverse transcriptase, integrase, protease yang dibungkus
dalam cone shapped core (lapisan berbantuk kerucut) yang tersusun dari protein capsid p24
dan bagian dalam protein matrix p17 yang berasal dari membran fosfolipid host yang
memeiliki protein membran gp 41 dan gp 120 yang akan berikatan dengan CD4 dan Reseptor
kemokin.
Gambar 5.13 Struktur Human Immunodeficiency Virus (HIV I)
Sumber : Cellular and Molecular Immunology.7th ed. 2012
Ekspresi gen HIV dibagi menjadi 2 tahap ekspresi gen,yaitu:
1) Early gen , mengekspresikan gen rev, tat, nef yang akan memproduksi protein yang
dikode gen ini segera setelah virus menginfeksi sel.
2) Late gen, mengekspresikan gen env, gag, dan pol, yang mengkode komponen struktural
HIV.
Gambar Genom Human Immunodeficiency Virus (HIV I)
Secara morfologi HIV-2 sama dengan HIV-1, tetapi kurang patogenik. Kedua tipe tesebut
dapat dibedakan melalui adanya atau tidak adanya antibodi yang spesifik pada HIV-2.
Meskipun reaktivitas (cross reactivity) terjadi antara protein inti kedua virus, tetapi protein
pembungkus (envelope) mereka berbeda.
B. CARA PENULARAN
Gambar 5.15 Cara Penularan HIV
Cara penularan HIV saat ini semakin jelas, meskipun virus dapat disiolasi dari banyak
hasil sekresi tubuh, infeksi ditularkan dari satu pasien ke pasien lain melalui tiga jalur
utama, yaitu :
1) Kontak seksual (hubungan seks), merupakan cara penularan paling besar terutama pada
kelompok heteroseksual dan homoseksual (laki-laki).
2) Penularan dari ibu ke anak, terjadi selama kehamilan melalui saluran plasenta dan setelah
melahirkan dari asi.
3) Inokulasi pasien oleh darah penderita HIV atau produk darah transfusi dari donor pemakai
obat/ narkoba melalui jarum suntik dan transfusi darah yang terinfeksi HIV
Penularan HIV melalui hubungan seksual merupakan jalur yang sangat penting. Di Afrika
dampak penularan secara heteroseksual, menunjukkan peningkatan jumlah wanita yang
terinfeksi dan menularkan infeksinya ke anak mereka. Dengan demikian peningkatan populasi
yang terinfeksi terjadi dari dua sisi, yaitu : pada orang dewasa (penularan secara horizontal)
dan pada bayi (penularan secara vertikal).
HIV ditularkan melalui kontak seksual, paparan darah yang terinfeksi atau sekret dari
kulit yang terluka, dan oleh ibu yang terinfeki ke janinnya atau melalui laktasi. Siklus replikasi
HIV dimulai dari ikatan antara HIV’s gp120 binding protein yang terletak di permukaan virus
dengan reseptor CD4+. Molekul gp 41 akan menetrasi membrane plasma sel target kemudian
membawa virion masuk kedalam sel target.
Sebuah kompleks preintegrasi virus yang terdiri dari RNA dan enzim virus dilepaskan ke
dalam sitoplasma sel target. Kompleks ini akan mencapai nukleus dan mempromosikan
transkripsi dari genom RNA menjadi DNA oleh enzim reverse transcriptase. Kompleks protein
coat akan menghasilkan double stranded DNA. Pada proses ini, genom viral rentan terhadap
faktor imunitas seluler yang menghambat progresifitas infeksi. DNA virus akan terintegrasi ke
dalam kromosom host oleh enzim integrase.
Telah diketahui bahwa sejumlah mekanisme untuk menurunkan CD4+ dapat diinduksi
oleh infeksi langsung dan destruksi oleh HIV. Kombinasi dari patogenitas virus dan respon
kekebalan tubuh yang terjadi selama infeksi mempengaruhi perkembangan stadium lanjut
penyakit yang merupakan suatu kompleks dan bervariasi.
Transfusi darah juga dapat menjadi jalur penularan HIV yang penting dan efisiensi
penularan HIV diperkirakan lebih dari 90%. Satu transfusi positif HIV rata-rata dapat
memicu kematian setelah jangka waktu dua tahun pada anak-anak dan lima tahun pada
orang dewasa. meskipun demikian, sejauh mana transfusi darah menjadi jalur penularan
utama tergantung pada prevalensi dari inidividu yang terinfeksi dala suatu populasi dan
efektivitas dari program uji saring yang dipakai . Jika dalam suatu populasi dimana
prevalensi pasien yang terinfeksi rendah dan program uji saring baik, maka penularan
melalui transfusi darah menjadi jarang dan dapat disimpulkan transfusi darah bukan
merupakan penularan HIV yang utama. Sebaliknya jika dalam suatu populasi ada
prevalensi pasien yang terinfeksi tinggi dan program uji saring jelek atau bahkan tidak ada,
maka penularan HIV lewat transfusi darah sangat mungkin terjadi dan merupakan jalur
penularan utama dalam populasi ini .
Langkah pertama untuk mencegah penularan melalui transfusi darah adalah dengan
menyeleksi donor, sehingga mendapat donor yang memiliki resiko rendah terhadap infeksi
yang ditularkan. Darah dari seorang donor yang aman akan memberikan darah donasi yang
aman untuk resipien. Meskipun demikian, tetap harus dilakukan atau melaksanakan program
uji saring antibodi HIV agar darah yang terinfeksi dapat diidentifikasi dan dibuang.
C. GEJALA KLINIS
Acquired Immunodeficiency Syndrome (AIDS) merupakan kumpulan gejala atau
penyakit yang disebabkan oleh menurunnya kekebalan tubuh akibat infeksi oleh virus HIV.
AIDS merupakan stadium ketika sistem imun penderita jelek dan penderita menjadi rentan
terhadap infeksi yang dinamakan infeksi oportunistik. Pada pasien yang terinfeksi HIV
dengan jumlah CD4 < 200μL juga merupakan definisi AIDS meskipun tanpa adanya gejala yang
terlihat atau infeksi oportunistik. Infeksi oportunistik merupakan infeksi yang tidak terkontrol
dari penyebab infeksi yang ada dan tidak dapat dikendalikan. Infeksi-infeksi umum ini
mencakup :
1) Pnemonia yang disebabkan oleh Pneumocytis carinii.
2) Tuberkulosis yang disebabkan oleh Mycobacterium tuberculosis atau Mycobacterium
avium / intracellularis.
3) Kriptosporidiosis kronis
4) Toxoplasmosis
5) Infeksi-infeksi virus lain, seperti Cytomegalovirus.
Kanker sekunder diantaranya sarkoma kaposi dan limfoma non-Hodgkins merupakan
kondisi lain yang kadangkala ditemukan pada pasien-pasien AIDS. Kanker ini biasanya ganas
dan tidak merespon secara baik pemberian kemoterapi standar. Beberapa negara di dunia,
ada pasien yang mengidap ARC (AIDS Related Complex) atau AIDS dengan diare berat.
Adanya infeksi oportunistik atau kanker-kanker sekunder hanya dapat ditentukan setelah
penelitian klinis dan hasil laboratorium.
Ada 2 klasifikasi yang sampai sekarang sering dipakai untuk remaja dan dewasa yaitu
klasifikasi menurut WHO dan Centers for Disease Control and Preventoin (CDC) Amerika
Serikat. Di negara-negara berkembang menggunakan sistem klasifikasi WHO dengan memakai
data klinis dan laboratorium, sementara di negara-negara maju dipakai sistem klasifikasi
CDC. Klasifikasi menurut WHO dipakai pada beberapa Negara yang pemeriksaan limfosit
CD4+ tidak tersedia. Klasifikasi stadium klinis HIV/AIDS WHO dibedakan menjadi 4 stadium,
yaitu :
Tabel 18. Stadium HIV menurut WHO
STADIUM GEJALA KLINIS
I -- Tidak ada penurunan berat badan
-- Tanpa gejala atau hanya Limfadenopati Generalisata Persisten
II -- Penurunan berat badan <10%
-- ISPA berulang: sinusitis, otitis media, tonsilitis, dan faringitis
STADIUM GEJALA KLINIS
-- Herpes zooster dalam 5 tahun terakhir
-- Luka di sekitar bibir (Kelitis Angularis)
-- Ulkus mulut berulang
-- Ruam kulit yang gatal (seboroik atau prurigo)
-- Dermatitis Seboroik
-- Infeksi jamur pada kuku
III -- Penurunan berat badan >10%
-- Diare, demam yang tidak diketahui penyebabnya >1 bulan
-- Kandidiasis oral atau Oral Hairy Leukoplakia
-- TB Paru dalam 1 tahun terakhir
-- Limfadenitis TB
-- Infeksi bakterial yang berat: Pneumonia, Piomiosis
-- Anemia (<8 gr/dl), Trombositopeni Kronik (<50109 per liter)
IV -- Sindroma Wasting (HIV)
-- Pneumoni Pneumocystis
-- Pneumonia Bakterial yang berat berulang dalam 6 bulan
-- Kandidiasis esofagus
-- Herpes Simpleks Ulseratif >1 bulan
-- Limfoma
-- Sarkoma Kaposi
-- Kanker Serviks yang invasif
-- Retinitis CMV
-- TB Ekstra paru
-- Toksoplasmosis
-- Ensefalopati HIV
-- Meningitis Kriptokokus
-- Infeksi mikobakteria non-TB meluas
-- Lekoensefalopati multifokal progresif
-- Kriptosporidiosis kronis, mikosis meluas
Di Indonesia, pada tahun 2007 oleh KPA (Komisi Penanggulangan AIDS) diagnosis AIDS
dengan kriteria WHO dipakai untuk keperluan surveilans epidemiologi. Dalam hal ini
seseorang dapat didiagnosis berdasarkan gejala klinis, yang terdiri dari gejala mayor dan
minor. Pasien yang dikatakan AIDS jika menunjukan hasil tes HIV positif disertai minimal
ada 2 gejala mayor atau ada 2 (dua) gejala minor dan 1 (satu) gejala mayor. Tabel
5.2 menunjukkan Gejala mayor dan gejala minor infeksi HIV / AIDS
Tabel 19. Gejala mayor dan minor infeksi HIV/AIDS
GEJALA MAYOR GEJALA MINOR
-- Berat badan turun >10% dalam 1 bulan
-- Diare kronik, berlangsung > 1 bulan
-- Demam berkepanjangan > 1 bulan
-- Penurunan Kesadaran
-- Demensia/HIV ensefalopati
-- Batuk menetap > 1 bulan
-- Dermatitis generalisata
-- Herpes Zooster multisegmental dan
berulang
-- Kandidiasis orofaringeal
-- Herpes simpleks kronis progresif
-- Limfadenopati generalisata
-- Infeksi jamur berulang pada alat
kelamin wanita
-- Retinitis Cytomegalovirus
D. METODE PEMERIKSAAN
Secara umum diagnosis HIV dibagi menjadi dua prinsip pendeteksian, yaitu deteksi
antibodi dan deteksi virus . RNA virus HIV dapat di deteksi menggunakan Nucleic Acid Test
(NAT) sekitar 11 hari setelah terinfeksi. Pemeriksaan skrining antibodi HIV dipakai untuk
diagnosis primer yang diikuti dengan tes konfirmasi jika hasil positif/reaktif pada hal hasil
pemeriksaan skrining. Selain metode ELISA (enzyme linked immunosorbent assay) dan juga
dipakai pemeriksaan partikel aglutinasi. Tes ELISA yang disetujui mengandung antigen HIV-
1 kelompok M, khususnya HIV-1 M: B, kelompok O dan HIV-2. Tergantung pada pabrikan,
antigen yang diturunkan dari reverse transcriptase dan protein p24 ditambahan dalam sistem
pemeriksaan. Selain itu, pemeriksaan bergantung pada respon imun dan titer antibodi. Infeksi
dapat dideteksi secara serologis setelah 3 minggu tapi biasanya setelah 4-5 minggu. Dalam
kasus yang jarang terjadi, orang yang terinfeksi HIV dengan imunosupresi lengkap
kemungkinan antibodi HIV-negatif, tetapi mereka memiliki gejala klinis khas HIV dan titer virus
yang terukur dalam darah.
Langkah pertama untuk mendiagnosis HIV/AIDS adalah anamnesis secara keseluruhan
kemudian ditemukan adanya faktor resiko dan menemukan temuan klinis pada pemeriksaan
fisik. Tes diagnostik untuk HIV yang sampai sekarang masih dipakai adalah ELISA (enzyme-
linked immunoabsorbent assay), rapid test, Western Blot, dan PCR (Polymerase chain
reaction) dengan sampel whole blood, dried bloodspots, saliva dan urin.
Rapid test disarankan untuk kasus kecelakaan kerja bagi petugas yang terpapar darah
penderita HIV/AIDS atau pada penderita yang kemungkinan tidak mau datang kembali untuk
menyampaikan hasil tes HIV. Tes ELISA merupakan pemeriksaan yang umum dilakukan karena
praktis dan sensitifitasnya tinggi. Rekomendasi WHO jika tes ELISA dengan 3 reagen yang
berbeda hasilnya postif semua atau rapid test dengan 3 reagen hasilnya positif semua maka
tidak dianjurkan tes Western Blot (WB). Berikut ini adalah algoritma untuk pemeriksaan HIV
pada donor
Pemeriksaan HIV 1/2 Metode Rapid Tet
Prinsip :
Pemeriksaan rapid tes ini merupakan uji kualitatif untuk mendeteksi antibodi spesifik
untuk HIV 1 (IgG, IgM, IgA) termasuk subtipe O dan atibodi HIV-2 dalam serum, plasma
atau darah lengkap. Pada bagian tes (T) membaran strip dilekatkan antigen
recombinant HIV-1 capture antigen (gp41, p24) pada daerah garis tes 1 dan antigen
recombinant HIV-2 capture antigen (gp36) pada daerah garis tes 2. Antigen
recombinan HIV-1/2 (gp41, p24 and gp36) dan colloid gold conjugate di bagian well
sampel akan berikatan dengan antibodi HIV1/2 pada sampel dan bergerak pada
membran kromatografi menuju daerah tes (T), sehingga apa bila ada antibodi HIV
1/2 akan membentuk garis nyata berwarna ungu pada daerah tes (T) yang merupakan
ikatan komplek antigen – antibodi – antigen gold partikel dengan spesisfisistas dan
sensitivitas yang tinggi . Kelebihan Antigen recombinan HIV-1/2 (gp41, p24 and gp36)
dan colloid gold conjugate akan terus bergerak menuju area kontrol (C) yang telah
dilapisi antibodi HIV1/2 rekombinan, sehingga berikatan dan membentuk garis merah
pada area kontrol yang menunjukkan hasil pemeriksaan valid. Hasil reaktif harus
dikonfirmasi menggunakan pemeriksaan HIV metode ELISA atau Western Blot.
Alat dan Bahan :
4) HIV 1/2 Rapid test ( test strip , diluent dan pipet kapiler)
5) Mikropipet (10 µL, 20 µL)
6) Tip kuning
7) Timer
8) Sampel pasien (serum atau plasma atau darah lengkap)
Cara kerja :
1) Siapakan alat dan bahan yang diperlukan,kemudian simpan pada suhu kamar.
2) Buka kemasan kit pemeriksaan pada permukaan yang datar dan kering.
3) Untuk sampel menggunakan pipet kapiler, dipipet 20µL sampel darah dan
masukkan ke dalam sampel well (S). Untuk sampel yang menggunakan mikropipet,
dipipet 10 µL untuk serum atau plasma dan jika menggunakan sampel darah
dipipet 20 µL , kemudian masukkan kedalam sampel well (S)
4) Tambahkan 4 tetes larutan diluent secara vertikal ke dalam sampel well (S).
Perhatian: jika meneteskan tidak vertikal maka akan mempengaruhi keakuratan
hasil, dianjurkan hanya 4 tetes, apabila berlebih (5-6 tetes) akan mempengaruhi
terbentuknya garis menjadi tidak jelas. .
5) Baca hasil pengamatan 10-20 menit. Peringatan : jangan membaca hasil lebih dari
20 menit
Interpretasi Hasil
- Negatif : hanya terbentuk satu garis pada daerah kontrol (C).
- Positif :
b) Positif HIV-1 : Terbentuk dua garis ungu, satu garis di daerah tes 1 (T1)
dan satu garis di daerah kontrol (C).
c) Positif HIV-2 : Terbentuk dua garis ungu, satu garis di daerah tes 2 (T2)
dan satu garis di daerah kontrol (C).
- Invalid : Tidak terbentuk garis pada daerah kontrol (C).
Catatan : apabila terbentuk 3 garis yaitu di daerah Tes 1 (T1), Tes 2 (T2) dan kontrol
(C), maka harus dikonfirmasi dengan western Blot untuk penentuan jenis virus.
Pemeriksaan HIV 1/2 Metode ELISA
Prinsip :
Gambar Prinsip pemeriksaan HIV 1/2 metode ELISA
Test Microlisa HIV merupakan test berbasis Indirect ELISA. Protein HIV envelope gp41,
gp 120 untuk HIV-1, dan gp 36 untuk HIV-2 yanga merupakan epitop imunodominan
dilekatkan pada sumur mikrotiter. Sampel dan kontrol ditambahkan ke dalam sumur
dan di inkubasi. Apabila pada sampel ada antibodi HIV-1 dan HIV 2 maka akan
berikatan dengan antigen spesifik yang telah dilekatkan pada permukaan sumur. Plate
kemudian dicuciuntuk menghilangkan komponen yang tidak berikatan. Horseradish
peroxidase (HRP) konjugat dan antihuman IgG ditambahkan ke dalam setiap well.
Konjugat akan berikatan dengan komplek HIV antigen-antibody yang terbentuk.
Selanjutnya larutan substrat yang mengandung kromogen dan hidrogen peroksida
ditambahkan pada setiap sumur dan diinkubasi. Warna biru yang terbentuk sebanding
dengan jumlah antibodi HIV-1 dan atau antibodi HIV-2 yang ada pada sampel.
Kemudian perubahan warna yang terbentuk dihentikan oleh stop solution. Warna yang
terbentuk dibaca pada ELISA reader dengan panjang gelombang 450 nm. Apabila
sampel tidak mengandung antibodi HIV-1 dan atau antibodi HIV-2, maka tidak akan
terbentuk warna biru pada sumur.
Alat dan bahan :
1) ELISA Kit untuk deteksi antibodi HIV-1/2
2) Mikropipet
3) Timer Elisa
4) reader Elisa
5) Washer ELISA
6) Inkubator370C
7) Vortex
8) Sarung tangan
9) Tisu atau kertas saring
10) Sampel (serum atau plasma)
Cara kerja
1) Dipipet 100 µl sample diluent dan masukkan ke sumur A-1 well sebagai blank.
2) Dipipet 100 µl kontrol negatif dan masukkan ke setiap sumur dengan nomor B-1 dan
C-1. Perhatian : negatif kontrol siap dipakai tidak perlu diencerkan.
3) Dipipet 100 µl Positif kontrol dan masukkan pada sumur D-1, E-1 & F-1. Perhatian :
negatif kontrol siap dipakai tidak perlu diencerkan.
4) Dipipet 100 µl sample diluent dan masukkan ke setiap sumur dimulai dari G-1 diikuti
dengan penambahan sampel sebanyak 10µl.
5) Tutup plate.
6) Inkubasi pada 37°C ± 2°C selama 30 menit ± 2 menit.
7) Selama inkubasi siapkan larutan pencuci (wash buffer) dan larutan kerja konjugat
spesifik.
8) Keluarkan plate dari inkubator dan cuci 5 kali dengan larutan pencuci (wash buffer)
9) Tambahkan 100 µl larutan HRP konjugat pada setiap sumur dari mulai A-1.
10) Tutup plate
11) Inkubasi pada 37°C ± 2°C selama 30 menit ± 2 menit
1
12) Buang dan cuci seperti prosedur no 8
13) Tambahkan 100 µl TMB substrat pada setiap sumur dari mulai A-1
14) Inkubasi pada suhu ruang (20 - 30ºC) selama 30 menit pada keadaan gelap
15) Tambahkan 100 µl of larutan stop pada setiap sumur.
16) Baca absorban pada panjang gelombang 450 nm dalam waktu 30 menit pada ELISA
READER setelah blanking sumur A-1.
Tes validitas :
1) Nilai absorban Blanko harus lebih kecil dari 0,100
2) Nilai absorban Negatif kontrol harus < 0,150
3) Nilai absorban Positif kontrol ha> 0,50
Interpretasi Hasil
1) Spesimen dengan absorbansi kurang dari (<) nilai cut-off dinyatakan negatif.
2) Spesimen dengan nilai absorbansi lebih besar atau sama dengan () nilai cut-off
dinyatakan positif.
Topik 3
Hepatitis C
A. STRUKTUR DAN MORFOLOGI
Hepatitis C adalah jenis yang paling berbahaya dari semua jenis virus hepatitis, karena
infeksi ini biasanya tidak menimbulkan gejala sampai di tahapan akhir infeksi kronis.
Kebanyakan orang tidak menyadari bahwa mereka terinfeksi hepatitis sampai akhirnya
menderita kerusakan hati permanen beberapa tahun kemudian, saat dilakukan tes medis
rutin.
Pada tahun 1980-an timbul sejumlah kasus hepatitis yang menyebar melalui transmisi
parenteral. Virus ini tidak dapat dikatagorikan dalam kelompok atau tipe virus hepatitis yang
ada saat itu, yaitu virus hepatitis A, B dan Delta. Seiring dengan perkembangan teknologi,
ditemukanlah metode isolasi dan karakterisasi RNA virus. Virus ini kemudian dikenal dengan
virus hepatitis C dan merupakan penyebab dominan kasus infeksi akibat virus hepatitis non A
dan non B (NANBH). Hepatitis C adalah peradangan hati yang disebabkan oleh virus hepatitis
C (hepatitis C virus/HCV), yaitu virus yang bergenom RNA untai tunggal dan dikatagorikan ke
dalam kelompok Flaviviridae . Dalam perjalanan penyakitnya hepatitis C dapat menjadi infeksi
akut dan infeksi kronis, dimana dari infeksi kronis ini dapat berkembang menjadi fibrosis
dan kanker hati . Hepatitis C juga berpotensi menjadi kejadian luar biasa (KLB). Oleh sebab itu
penyakit hepatitis C masih termasuk dalam masalah kesehatan utama di indonesia.
Patogenesis infeksi HCV hingga memicu hepatitis C tidak lepas dari peran struktur
genom yang dimilikinya. Sekitar 9600 nukleotida menyusun sebuah Untranslated Region dan
Open Reading Frame (ORF). Open Reading Frame akan mengkode sejumlah protein fungsional
yang berperan dalam membentuk struktur virus serta berperan dalam patogenesis infeksi,
terutama dalam hal mekanisme replikasi virus dalam sel inang. Struktur genom virus hepatitis
C, partikel HCV (virion) terdiri berukuran 40-70 nm. Virion terdiri dari bagian inti (core) yang
mengandung materi genetik berupa satu untai RNA yang dikelilingi oleh lapisan protein
pelindung dengan struktur ikosahedral yang disebut nukleokapsid. Pada bagian luar
nukleokapsid ada lapisan lipid dan glikoprotein yang membentuk struktur envelop. Open
Reading Frame mengkodekan sekitar 3000 asam amino, poliprotein ini kemudian menjadi 10
protein fungsional pascatranslasi melalui proses yang melibatkan sejumlah proteinase milik
sel inang dan virus.
Gambar 5.18 Genom Virus Hepatitis C
Pada bagian ujung terminal 5’ dan 3’ ada daerah yang disebut Untraslated Region
(UTR). Daerah ini tidak mengkodekan protein apapun, namun berperan penting dalam inisiasi
traskripsi dan translasi. Bagian yang terletak di ujung 5’ disebut daerah 5’UTR, sedangkan yang
terletak di ujung 3’ disebut 3’UTR. poliprotein post tranlasi terdiri dari protein struktural
(terletak di dekat ujung amino) dan protein non struktural (terletak di dekat ujung karboksil).
protein struktural adalah protein yang berperan dalam pembentukan struktur virus, yaitu
protein core, E1, E2 dan P7. protein non struktural terdiri dari NS2, NS3, NS4 dan NS5.
Beberapa dari protein ini akan dipotong menjadi protein berukuran kecil yang berperan dalam
replikasi virus. rantai poliprotein yang terbentuk akan dipotong melalui mekanisme yang
disebut chopping. pemotongan ini dilakukan oleh sejumlah protease.
B. CARA PENULARAN
Pada biasanya cara penularan HCV adalah parental. Semula penularan HCV
dihubungkan dengan transfusi darah atau produk darah, melalui jarum suntik. Tetapi setelah
ditemukan bentuk virus dari hepatitis, makin banyak laporan mengenai cara penularan
lainnya, yang biasanya mirip dengan cara penularan HBV, yaitu:
1) Penularan horizontal
Penularan HCV terjadi terutama melalui cara parental, yaitu tranfusi darah atau
komponen produk darah, hemodialisa, dan penyuntikan obat secara intravena.
2) Penularan vertikal
Penularan vertikal adalah penularan dari seseorang ibu pengidap atau penderita
Hepatitis C kepada bayinya sebelum persalinan, pada saat persalinan atau beberapa saat
persalinan.
Jika masuk ke dalam darah maka HCV akan segera menuju hepatosit (sel hati) dan dan
juga sel limfosit B. Hanya dalam sel hati HCV bisa berkembang biak. sebab sulitnya
membiakkan HCV pada kultur, juga tidak adanya model binatang non-primata telah
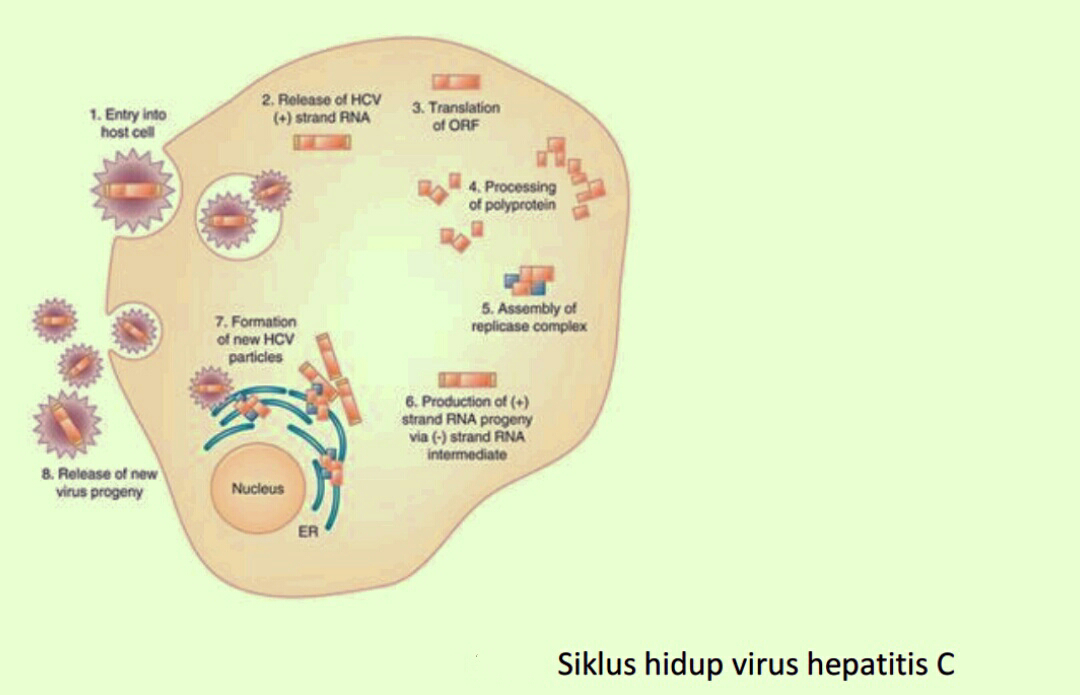
memperlambat lajunya riset HCV. Berikut ini adalah daur hidup HCV (Gambar 5.11).
Gambar 5.19. Siklus hidup virus hepatitis C
Melalui gambar skematis di atas, proses siklus kehidupan HCV digambarkan secara alur
skematis.
1
1) HCV masuk ke dalam hepatosit dengan mengikat suatu reseptor permukaan sel yang
spesifik. Reseptor ini belum teridentifikasi secara jelas, namun protein permukaan CD8+
adalah suatu HCV binding protein yang memainkan peranan dalam masuknya virus. Salah
satu protein khusus virus yang dikenal sebagai protein E2 menempel pada reseptor site di
bagian luar hepatosit.
2) Kemudian protein inti dari virus menembus dinding sel dengan suatu proses kimiawi
dimana selaput lemak bergabung dengan dinding sel dan selanjutnya dinding sel akan
melingkupi dan menelan virus serta membawanya ke dalam hepatosit. Di dalam
hepatosit, selaput virus (nukleokapsid) melarut dalam sitoplasma dan keluarlah RNA virus
(virus uncoating) yang selanjutnya mengambil alih peran bagian dari ribosom hepatosit
dalam membuat bahan-bahan untuk proses reproduksi.
3) Virus dapat membuat sel hati memperlakukan RNA virus seperti miliknya sendiri. Selama
proses ini virus menutup fungsi normal hepatosit atau membuat lebih banyak lagi
hepatosit yang terinfeksi kemudian menbajak mekanisme sintesis protein hepatosit
dalam memproduksi protein yang dibutuhkannya untuk berfungsi dan berkembang biak.
4) RNA virus dipergunakan sebagai cetakan (template) untuk memproduksi masal
poliprotein (proses translasi).
5) Poliprotein dipecah dalam unit-unit protein yang lebih kecil. Protein ini ada 2 jenis yaitu
protein struktural dan regulatori. Protein regulatori memulai sintesis kopi virus RNA asli.
6) Sekarang RNA virus mengopi dirinya sendiri dalam jumlah besar (miliaran kali) untuk
menghasilkan bahan dalam membentuk virus baru. Hasil kopi ini adalah bayangan cermin
RNA orisinil dan dinamai RNA negatif. RNA negatif lalu bertindak sebagai cetakan
(template) untuk memproduksi serta RNA positif yang sangat banyak yang merupakan
kopi identik materi genetik virus.
7) Proses ini berlangsung terus dan memberikan kesempatan untuk terjadinya mutasi
genetik yang menghasilkan RNA untuk strain baru virus dan subtipe virus hepatitis C.
Setiap kopi virus baru akan berinteraksi dengan protein struktural, yang kemudian akan
membentuk nukleokapsid dan kemudian inti virus baru. Amplop protein kemudian akan
melapisi inti virus baru.
8) Virus dewasa kemudian dikeluarkan dari dalam hepatosit menuju ke pembuluh darah
menembus membran sel.
Keluaran dan derajat keparahan dari infeksi virus hepatitis bergantung pada jenis virus,
jumlah virus dan faktor dari host.
C. GEJALA KLINIS
Manifestasi klinis hepatitis virus C dikenal mulai dari hepatitis akut, fulminan, kronis,
yang dapat berkembang menjadi sirosis atau kanker hati.
1) Infeksi Akut
Umumnya infeksi akut HCV tidak memberi gejala atau hanya bergejala minimal. Hanya
20-30% kasus yang menunjukkan tanda-tanda hepatitis akut 7 – 8 minggu (berkisar 2 – 26
minggu) setelah terjadinya paparan.
Infeksi virus hepatitis terbagi 3 fase, yaitu fase prodormal, fase ikterik, dan fase
convalescent. Pada fase prodormal, onset terjadi pada hari 1-14, namun rata-rata timbul pada
hari 5-7 setelah paparan. Keluhan yang sering yaitu malaise, fatique, mual dan muntah,
kehilangan selera makan, demam , gejala flu , dan kebanyakan pasien mengeluh adanya nyeri
pada perut kanan atas.
Pada fase ikterik, gejala yang sering ditimbulkan yaitu warna kuning pada mukosa sklera
pada awalnya dan berlanjut pada perubahan warna pada kulit. Durasi ikterik bervariasi,
biasanya antara 4 hari sampai beberapa bulan, namun rata-rata 2-3 minggu. Urin menjadi
gelap, feses berwarna seperti dempol (pucat). Selama fase ini, setengah penderita
menunjukkan gejala gatal-gatal.
Pada fase convalescent, kebanyakan gejala di atas menghilang (resolve). Ikterik tidak
ditemukan, warna pada kulit, urin dan feses kembali ke warna yang semula. Kembalinya nafsu
makan dan adanya peningkatan berat badan menunjukkan sudah adanya tahap
penyembuhan.
Umumnya secara klinik gejala HCV akut lebih ringan daripada hepatitis virus akut
lainnya. Masa inkubasi HCV terletak antara HAV dengan HBV, yaitu sekitar 2 – 26 minggu,
dengan rata-rata 8 minggu. Pada penderita hepatitis akut ditemukan Anti HCV positif pada
75,5% HNANB pasca-tranfusi, 35% pada HNANB sporadik dan hanya 2,4 pada HBV. Sebagian
besar penderita yang terserang HCV akut akan menjurus menjadi kronis.
RNA virus hepatitis C dapat terdeteksi sebelum gejala muncul, namun level dari viremia
pada 6 bulan pertama dapat dorman dan tidak terdeksi walaupun orang ini sedang
dalam infeksi yang persisten. Gejala awal yang ditunjukkan tergantung dari usia saat
terjadinya paparan, sistem imun penderita, adanya penyakit hati sebelumnya dan tingkat
inokulasi virus.
Level serum dari enzim hati seperti alanin aminotransferase (ALT) meningkat 10 kali
lebih tinggi dari pada normal, kemudian menurun, dan untuk orang dengan infeksi yang
persisten didapatkan kadar ALT naik turun (fluktuatif). Serum bilirubin juga dapat meningkat
setelah beberapa minggu gejala pertama muncul, namun akhirnya kembali ke level yang
normal. Secara garis besar, angka mortalitas pada infeksi akut tergolong rendah.
2) Infeksi Kronis
Infeksi akan menjadi kronik pada 70 – 90% kasus dan sering kali tidak menimbulkan
gejala apapun walaupun proses kerusakan hati berjalan terus. Adapun kriteria dari hepatitis
kronis adalah naiknya kadar transaminase serum lebih dari 2 kali nilai normal, yang
berlangsung lebih dari 6 bulan. Hilangnya HCV setelah terjadinya hepatitis kronis sangat jarang
terjadi. Jangka waktu dimana berbagai tahap penyakit hati berkembang sangat bervariasi.
Diperlukan waktu 20 – 30 tahun untuk terjadinya sirosis hati yang sering tejadi pada 15 – 20%
pasien hepatitis C kronis. Progresivitas hepatitis kronik menjadi sirosis hati tergantung
beberapa faktor resiko yaitu: asupan alkohol, ko-infeksi dengan virus hepatitis B atau Human
Immunodeficiency Virus (HIV), jenis kelamin laki-laki, usia tua saat terjadinya infeksi dan kadar
CD4+ yang sangat rendah. Bila telah terjadinya sirosis, maka risiko terjadinya karsinoma
hepatoselular adalah sekitar 1-4% pertahun. Karsinoma hepatoseluler dapat terjadi tanpa
diawali dengan sirosis, namun hal ini jarang terjadi.
3) Hepatitis C Fulminan
Hepatitis fulminan jarang terjadi. ALT (alanine amino-transferase) meninggi sampai
beberapa kali diatas batas atas normal tetapi biasanya tidak sampai lebih dari 1000 U/L.
Selain memiliki manifestasi hepatik, ada beberapa manifestasi ektrahepatik HCV yang penting
a) Mixed Cryoglobulinaemic vasculitis
Pada 50% pasien HCV biasanya terdeteksi cryoglobulin pada serum darah, dan
Kriopresipitat biasanya mengandung sejumlah besar antigen dan antibodi HCV, namun
hanya sebagian kecil pasien (10-15%) yang memiliki gejala. Gejala-gejala biasanya terkait
dengan vaskulitis, yaitu lemah, atralgia dan purpura.
b) Membranoproliferative glomerulonephritis
Pada kasus ini, telah terjadi peranan dari persarafan dan otak sehingga gejala yang
timbul lebih berat.
c) Poliarteritis Nodosa
d) Papular Acrodermatitis (Gianotti syndrome)
D. METODE PEMERIKSAAN
Penegakan diagnosis pada hepatitis virus C berdasarkan uji serologi untuk memeriksa
antibodi dan Uji HCV RNA.
1) Uji serologi
Uji serologi yang berdasarkan pada deteksi antibodi telah membantu mengurangi risiko
infeksi terkait transfusi. Sekali pasien pernah mengalami serokonversi, biasanya hasil
pemeriksaan serologi akan tetap positif, namun kadar antibodi anti-HCV akan menurun
secara gradual sejalan dengan waktu pada sebagian pasien yang infeksinya mengalami reaksi
spontan.
Antibodi terhadap HCV biasanya dideteksi dengan metode enzyme immunoassay yang
sangat sensitif dan spesifik. Enzyme immunoassay generasi k-3 yang banyak dipergunakan
saat ini mengandung protein core dan protein struktural-struktural yang dapat mendeteksi
keberadaan antibodi dalam waktu 4-10 minggu infeksi. Antibodi anti-HCV masih tetap dapat
terdeteksi selama terapi maupun setelahnya tanpa memandang respon terapi yang telah
dialami, sehingga pemeriksaan anti-HCV tidak perlu dilakukan kembali apabila sudah pernah
dilakukan sebelumnya. Uji immunoblot rekombinan (recombinant immunoblot assay, RIBA)
dapat dipakai untuk mengkonfirmasi hasil uji enzyme immunoassay yang
positif. Penggunaan RIBA untuk mengkonfirmasi hasil hanya direkomendasikan untuk setting
populasi resiko rendah seperti pada bank darah. Namun dengan tersedianya metode enzyme
immunoassay yang sudah diperbaiki dan uji deteksi RNA yang lebih baik saat ini, maka
konfirmasi denga RIBA telah menjadi kurang diperlukan.
2) Uji HCV RNA
HCV RNA dapat terdeteksi dan diukur dengan teknik amplifikasi termasuk reverse
transcription polymerase chain reation (RT-PCR). Genotip HCV dapat dinilai dengan analisis
phylogenetic dari rantai nukleotida atau deteksi mutasi point spesifik subtipe pada RT-PCR
amplifikasi RNA. HCV RNA dideteksi dalam waktu 2 minggu infeksi dan juga dipakai untuk
konfirmasi terjadinya infeksi akut. Bagaimanapun uji HCV RNA yang rutin tidak dianjurkan
secara langsung karena standarisasi uji ini yang masih rendah.
3) Biopsi Hati
Biopsi hati secara umum direkomendasikan untuk penilaian awal seorang pasien dengan
infeksi HCV kronis. Biopsi berguna untuk menentukan derajat beratnya penyakit (tingkat
fibrosis) dan menentukan derajat nekrosis dan inflamasi.1 Pemeriksaan ini juga bermanfaat
untuk menyingkirkan kemungkinan adanya penyebab hati yang lain, seperti fitur
alkoholik, non-alcoholic steatohepatits (NASH), hepatitis autoimun, penyakit hati drug-
induced atau overload besi.
Pemeriksaan HIV 1/2 Metode Rapid Tet
Prinsip : Pemeriksaan rapid tes ini merupakan uji kualitatif untuk mendeteksi antibodi
spesifik untuk HCV dalam serum atau plasma. Pada bagian sampel (S) membran strip
dilekatkan antigen recombinant HCV dan colloid gold conjugate yang berikatan dengan
antibodi HCV pada sampel, kemudian bergerak pada membran kromatografi menuju
daerah tes (T) yang telah dilekatkan antigen rekombinan HCV(antigen HCV Core, NS3, NS4,
NS5), sehingga apabila ada antibodi HCV pada sampel akan membentuk garis nyata
berwarna ungu pada daerah tes (T) yang merupakan ikatan komplek antigen – antibodi –
antigen gold partikel dengan spesisfisistas dan sensitivitas yang tinggi . Kelebihan Antigen
recombinan HCV dan colloid gold conjugate akan terus bergerak menuju area kontrol (C)
yang telah dilapisi antibodi HCV rekombinan, sehingga berikatan dan membentuk garis
merah pada area kontrol yang menunjukkan hasil pemeriksaan valid.
Alat dan Bahan :
HCV Rapid test ( test strip , diluent dan pipet kapiler)
Mikropipet (10 µL)
Tip kuning
Timer
Sampel pasien (serum atau plasma)
Cara kerja :
1) Siapakan alat dan bahan yang diperlukan,kemudian simpan pada suhu kamar.
2) Buka kemasan kit pemeriksaan pada permukaan yang datar dan kering.
3) Untuk sampel menggunakan pipet kapiler atau mikropipet, dipipet 10µL sampel
darah dan masukkan ke dalam sampel well (S).
4) Tambahkan 3 tetes larutan diluent secara vertikal ke dalam sampel well (S).
5) Baca hasil pengamatan 5-20 menit. Peringatan : jangan membaca hasil lebih dari 20
menit
Interpretasi Hasil
- Negatif : hanya terbentuk satu garis pada daerah kontrol (C).
- Positif : Terbentuk dua garis ungu, satu garis di daerah tes (T) dan satu garis di
daerah kontrol (C).
Derajat warna yang terbentuk pada hasil positif
- Invalid : Tidak terbentuk garis pada daerah kontrol (C).
Pemeriksaan HCV Metode ELISA
Prinsip :
Test Microlisa HIV merupakan test berbasis Indirect ELISA. Protein recombinant HCV
Core, protein NS3 dan sintetis peptida yang memiliki segmen antigenik, NS4 and NS5
regions dari virus hepatitis C dilekatkan pada sumur mikrotiter. Sampel dan kontrol
ditambahkan ke dalam sumur dan di inkubasi. Apabila pada sampel ada antibodi
HCV maka akan berikatan dengan antigen spesifik yang telah dilekatkan pada
permukaan sumur. Plate kemudian dicuciu ntuk menghilangkan komponen yang tidak
berikatan. Horseradish peroxidase (HRP) konjugat dan antihuman IgG ditambahkan ke
dalam setiap well. Konjugat akan berikatan dengan komplek HCV antigen-antibodi
yang terbentuk. Selanjutnya larutan substrat yang mengandung kromogen dan
hidrogen peroksida ditambahkan pada setiap sumur dan diinkubasi. Warna biru yang
terbentuk sebanding dengan jumlah antibodi HCV yang ada pada sampel.
Kemudian perubahan warna yang terbentuk dihentikan oleh stop solution. Warna yang
terbentuk dibaca pada ELISA reader dengan panjang gelombang 450nm / 630 nm.
Apabila sampel tidak mengandung antibodi HCV, maka tidak akan terbentuk warna
biru pada sumur.
Alat dan bahan :
a. Reagen ELISA untuk deteksi antibodi HCV
1
b. Mikropipet
c. Timer Elisa
d. reader Elisa
e. Washer ELISA
f. Inkubator370C
g. Vortex
h. Sarung tangan
i. Tisu atau kertas saring
j. Sampel (serum atau plasma)
Cara Kerja :
1) Siapkan alat dan bahan yang dibutuhkan. Simpan pada suhu kamar sebelum
dipakai .
2) Beri label setiap well. Label diberikan pada satu sumur (A1) sebagai blanko dan
dua sumur (B1 & C1) sebagai negatif kontrol dan tiga sumur (D1, E1 & F1) sebagai
positif kontrol
3) Tambahkan 100µl positif dan negatif kontrol (langsung dipakai )sesuai label
pada sumur.
4) Tambahkan 100 µl larutan pengencer pada setiap sumur untuk sampel
5) Tambahkan 10µl sampel pada sumur yang ada larutan pengencer tadi dan
homogenkan
6) Tutup mikroplate dan inkubasi pada suhu kamar (25-30°C) selama 30 menit
7) Cuci mikroplate sebanyak 5 kali dengan penambahan 300µl setiap sumur dengan
larutan buffer pencuci. Hati-hati jangan sampai kontaminasi
8) Tambahkan 100µl larutan HRP konjugat pada setiap sumur.
9) Tutup mikroplate dan inkubasi pada suhu kamar (25-30°C) selama 30 menit
10) Cuci mikroplate sebanyak 5 kali dengan penambahan 300µl setiap sumur dengan
larutan buffer pencuci. Hati-hati jangan sampai kontaminasi.
11) Tambahkan 100µl larutan TMB substrat pada setiap sumur.
12) Tutup mikroplate dan inkubasi pada suhu kamar (25-30°C) selama 30 menit
(keadaan gelap)
13) Hentikan reaksi dengan penambahan 100ul of the stop solution pada setiap
sumur.
14) Baca absorban pada panjang gelombang 450nm/630nm dalam waktu 30 menit
pada ELISA READER Dipipet 100 µl sample diluent dan masukkan ke sumur A-1 well
sebagai blank.
Tes validitas :
4) Nilai absorban Blanko harus lebih kecil dari 0,150
5) Nilai absorban Negatif kontrol harus < 0,250
6) Nilai absorban Positif kontrol harus > 0,60
Interpretasi Hasil
1) Spesimen dengan absorbansi kurang dari (<) nilai cut-off dinyatakan negatif.
2) Spesimen dengan nilai absorbansi lebih besar atau sama dengan () nilai cut-off
dinyatakan positif.
Topik 4
Sifilis
A. STRUKTUR DAN MORFOLOGI
Sifilis merupakan penyakit kronis dan bersifat sistemik yang disebabkan oleh treponema
palidum. Angka kejadian sifilis mencapai 90% dinegara-negara berkembang. World Health
Organization (WHO) memperkirakan sebesar 12 juta kasus baru terjadi di afrika, Asia Selatan,
Asia Tenggara, Amerika Latin dan Caribbean. Angka kejadian Sifilis di Indonesia berdasarkan
laporan Survey Terpadu dan Biologis Perilaku (STBP) tahun 2011 Kementrian Kesehatan RI
terjadi peningkatan angka kejadian Sifilis di tahun 2011 dibandingkan tahun 2007.
Treponema pallidum merupakan spesies treponema dari famili Spirochaeta, ordo
Spirochaetales, taksonomi dapat dilihat pada tabel 21.
Tabel 20. Taksonomi Treponema pallidum
TINGKATAN NAMA
Kingdom Bacteria
Phylum Spirochaetes
Ordo Spirochaetales
Family Spirochaetaceae
Genus Treponema
Species T. Pallidum
Subspecies Pallidum
Treponema pallidum berbentuk spiral, gram negatif dengan panjang kisaran 11 µm
dengan diameter antara 0,09 – 0,18 µm. ada dua lapisan, sitoplasma merupakan lapisan
dalam mengandung mesosom, vakuol ribosom dan bahan nukleoid, lapisan luar yaitu bahan
mukoid.
Gambar Struktur Treponema pallidum
B. CARA PENULARAN
Treponema palidum masuk melalui selaput lendir yang utuh, atau kulit yang mengalami
abrasi, menuju kelenjar limfe, kemudian masuk ke dalam pembuluh darah, dan diedarkan ke
seluruh tubuh. Biasanya dapat ditularkan melalui hubungan sekseual (membran mukosa atau
uretra), kontak langsung dengan lesi atau luka yang terinfeksi, transfusi darah dan juga dari
ibu yang menderita sifilis ke janin yang dikandung melalui plasenta pada stadium akhir
kehamilan.
Setelah beredar beberapa jam, infeksi menjadi sistemik walaupun tanda-tanda klinis dan
serolois belum jelas. Sekitar satu minggu setelah terinfeksi Treponema palidum, ditempat
masuknya akan timbul lesi primer berupa ulkus. Ulkus akan muncul selama satu hingga lima
minggu dan kemudian menghilang. Uji serologis masih akan negatif ketika ulkus pertama kali
muncul dan baru akan reaktif setelah satu sampai empat minggu berikutnya. Enam minggu
kemudian, timbul erupsi seluruh tubuh pada sebagian kasus sifilis sekunder dan ruam ini akan
hilang kisaran dua sampai enam minggu, karena terjadi penyembuhan spontan. Perjalanan
penyakit menuju ke tingkat laten, dimana tidak ditemukan tanda-tanda klinis, kecuali hasil
pemeriksaan serologis yang reaktif. Masa laten dapat berlangsung bertahun-tahun atau
seumur hidup.
C. GEJALA KLINIS
Stadium sifilis dalam perjalanannya dibagi menjadi tiga stadium yaitu sifilis stadium
primer, sekunder dan tersier yang terpisah oleh fase laten dimana waktu bervariasi, tanpa
tanda klinis infeksi. Interval antara stadium primer dan sekunder berkisar dari beberapa
minggu sampai beberapa bulan. Interval antara stadium sekunder dan tersier biasanya lebih
dari satu tahun.
Sifilis Primer
Lesi awal sifilis berupa papul yang muncul di daerah genitalia kisaran tiga minggu setelah
kontak seksual. Papul membesar dengan ukuran 0,5 – 1,5 cm kemudian mengalami ulserasi,
membentuk ulkus. Ulkus sifilis yang khas berupa bulat, diameter 1-2 cm , tidak nyeri, dasar
ulkus bersih tidak ada eksudat, teraba indurasi, soliter tetapi dapat juga multipel. Hampir
sebagian besar disertai pembesaran kelenjar getah bening inguinal medial unilateral atau
bilateral. Gambaran chancre sifilis primer dapat dilihat pada gambar .
Gambar chancre sífilis primer pada penis
Chancre sífilis primer sering terjadi pada genitalia, perineal, atau anus dikarenakan
penularan paling sering melalui hubungan seksual, tetapi bagian tubuh yang lain dapat juga
terkena. Ulkus jarang terlihat pada genitalia eksterna wanita, karena lesi sering pada vagina
atau serviks. Dengan menggunakan spekulum, akan terlihat lesi di serviks berupa erosi atau
ulserasi yang dalam. Tanpa pengobatan lesi primer akan sembuh spontan dalam waktu 3
sampai 6 pekan. Diagnosis banding sifilis primer yaitu ulkus mole yang disebabkan
Haemophilus ducreyi, limfogranuloma venereum, trauma pada penis, fixed drug eruption,
herpes genitalis.
Sifilis Sekunder
Manifestasi akan timbul pada beberapa minggu atau bulan, muncul gejala sistemik
berupa demam yang tidak terlalu tinggi, malaise, sakit kepala, adenopati, dan lesi kulit atau
mukosa. Lesi sekunder yang terjadi merupakan manifestasi penyebaran Treponema pallidum
secara hematogen dan limfogen. Manifestasi klinis sifilis sekunder dapat berupa berbagai
ruam pada kulit, selaput lendir, dan organ tubuh. Lesi kulit biasanya simetris, dapat berupa
makula, papula, folikulitis, papuloskuamosa, dan pustul, jarang disertai keluhan gatal. Lesi
dapat ditemukan di trunkus dan ekstermitas, termasuk telapak tangan dan kaki. Papul
biasanya merah atau coklat kemerahan, diskret, diameter 0,5 – 2 cm, biasanya berskuama
tetapi kadang licin. Lesi vesikobulosa dapat ditemukan pada sifilis kongenital.
Kondiloma lata merupakan istilah untuk lesi meninggi (papul), luas, putih atau abu-abu
di daerah yang hangat dan lembab. Lesi sifilis sekunder dapat muncul pada waktu lesi sifilis
primer masih ada. Diagnosis sifilis sekunder ditegakkan berdasarkan hasil pemeriksaan
serologis yang reaktif dan pemeriksaan lapangan gelap positif. Treponema pallidum banyak
ditemukan pada lesi selaput lendir atau basah seperti kondiloma lata.
Ruam kulit pada sifilis sekunder sukar dibedakan dengan pitiriasis rosea, psoriasis,
terutama jika berskuama, eritema multiforme dan erupsi obat. Diagnosis sifilis sekunder
cukup sulit. Pada biasanya diagnosis ditegakkan berdasarkan kelainan khas lesi kulit sifilis
sekunder ditunjang dengan pemeriksaan serologis.
Sifilis Laten
Sifilis laten yaitu apabila pasien dengan riwayat sifilis dan pemeriksaan serologis reaktif
yang belum mendapat terapi sifilis dan tanpa gejala atau tanda klinis. Sifilis laten terbagi
menjadi dini dan lanjut, dengan batasan waktu kisaran satu tahun. Dalam perjalanan penyakit
sifilis akan melalui tingkat laten, selama bertahun-tahun atau seumur hidup. Tetapi
bukan bearti penyakit akan berhenti pada tingkat ini, sebab dapat berjalan menjadi sifilis
tersier.
Sifilis Tersier
Sifilis tersier terdiri dari tiga grup sindrom yang utama yaitu neurosifilis, sifilis
kardiovaskular, dan sifilis benigna lanjut. Pada perjalanan penyakit neurosifilis dapat
asimptomatik dan sangat jarang terjadi dalam bentuk murni. Pada semua jenis neurosifilis,
terjadi perubahan berupa endarteritis obliterans pada ujung pembuluh darah disertai
degenerasi parenkimatosa yang mungkin sudah atau belum menunjukkan gejala saat
pemeriksaan.
1
Sifilis kardiovaskular disebabkan terutama karena nekrosis aorta yang berlanjut ke
katup. Tanda-tanda sifilis kardiovaskuler adalah insufisiensi aorta atau aneurisma, berbentuk
kantong pada aorta torakal. Bila komplikasi ini telah lanjut, akan sangat mudah dikenal.
Sifilis benigna lanjut atau gumma merupakan proses inflamasi proliferasi granulomatosa
yang dapat memicu destruksi pada jaringan yang terkena. Disebut benigna sebab jarang
memicu kematian kecuali bila menyerang jaringan otak. Gumma mungkin terjadi akibat
reaksi hipersensitivitas infeksi Treponema palidum. Lesi sebagian besar terjadi di kulit dan
tulang. Lesi pada kulit biasanya soliter atau multipel, membentuk lingkaran atau setengah
lingkaran, destruktif dan bersifat kronis, penyembuhan di bagian sentral dan meluas ke
perifer. Lesi pada tulang biasanya berupa periostitis disertai pembentukan tulang atau osteitis
gummatosa disertai kerusakan tulang. Gejala khas ialah pembengkakan dan sakit. Lokasi
terutama pada tulang kepala, tibia, dan klavikula. Pemeriksaan serologis biasanya reaktif
dengan titer yang tinggi.
Sifilis Kongenital
Penyakit yang ditularkan kepada janin dalam uterus dari ibu yang positif menderita
sifilis. Infeksi sifilis terhadap janin dapat terjadi pada setiap stadium sifilis dan setiap masa
kehamilan. Dahulu beberapa pendapat menyatakan infeksi tidak dapat terjadi sebelum janin
berusia 18 minggu, karena lapisan Langhans yang merupakan pertahanan janin terhadap
infeksi sebelum atrofi. Tetapi kenyataannya dengan pengamatan menggunakan mikroskop
elektron dapat ditemukan Treponema pallidum pada janin berusia 9-10 minggu.
D. METODE PEMERIKSAAN
ada dua jenis uji serologi untuk diagnosis Treponema pallidum, yaitu :
6) Uji non-treponemal, merupakan uji yang paling sering dilakukan adalah sebagai
berikut
- Uji Venereal Disease Research Laboratory (VDRL)
- Uji Rapid Plasma Reagin.
Kedua pemeriksaan ini dipakai untuk mendeteksi antobodi terhadap antigen yang
terdiri dari kardioplin, kolesterol dan lesitin yang sudah terstandarisasi.
7) Uji treponemal, terdiri dari :
- Treponema pallidum Haem Aglutination (TPHA)
- Treponema pallidum Particle Agglutination (TP-PA)
- Flouresencent Treponemal Antibody Absorption (FTA-ABS)
- Micro Hemagglutination Assay for antibodies to Treponema pallidum (MHA-TP)
- Treponemal Enzyme Immuno Assay (EIA) untuk deteksi imunoglobulin G (IgG),
imunoglobulin G dan M (IgG dan IgM) atau imunoglobulin M (IgM)
Pemeriksaan ini mendeteksi antibodi terhadap antigen treponemal dan memilki
sensitivitas yang lebih tinggi dibandingkan dengan uji nontreponemal terutama sifilis
lanjut.
Pemeriksan VDRL / RPR
Pemeriksaan Venereal Disease Research Laboratory (VDRL) / Serum atau
Cerebrospinal Fluid (RPR) merupakan satu-satunya pemeriksaan laboratorium untuk
neunurosipilis yang disetujui oleh Centers for Disease Control. Pemeriksaan VDRL serum
bisa memberikan hasil negatif palsu pada tahap late sipilis dan kurang sensitif dari RPR.
Pemeriksaan VDRL merupakan pemeriksaan penyaring atau Skrining Test, dimana apabila
VDRL positif maka akan dilanjutkan dengan pemeriksaan TPHA (Trophonema Phalidum
Heamaglutinasi). Hasil uji serologi tergantung pada stadium penyakit misalnya pada infeksi
primer hasil pemeriksaan serologi biasanya menunjukkan hasil non reaktif. Troponema
palidum dapan ditemukan pada chancre. Hasil serologi akan menunjukan positif 1-4
minggu setelah timbulnya chancre. Dan pada infeksi sekunder hasil serelogi akan selalu
pisitif dengan titer yang terus meningkat. Pasien yang terinfeksi bakteri treponema akan
membentuk antibody yang terjadi sebagai reaksi bahan-bahan yang dilepaskan karena
kerusakan sel-sel. Andibody ini disebut reagin.
a. Tujuan : Untuk mendeteksi adanya antibody nontreponema atau Reagin.
b. Metode Pemeriksaan : Slide
c. Prinsip Pemeriksaan : Adanya antibody pada serum pasien akan bereaksi dengan
antigen yang terdiri dari kardioplin, kolesterol dan lesitin yang sudah terstandarisasi
membentuk flokulasi ( gumpalan) atau aglutinasi.
d. Spesimen Pemeriksaan : Serum atau cairanotak
e. Alat dan Bahan Pemeriksaan
1. Slide pemeriksaan berlatar belakan putih
2. Mikroskop
3. Mikropipet
4. Tip kuning
5. Rotator
6. Timer
7. Batang pengaduk
1
f. Cara Kerja
a) Kualitatif
o Siapkan alat dan bahan yad dibutuhkan.
o Ke dalam lingkaran slide dipipet 50 ul serum.
o Tambahkan 50 ul atau 1 tetes antigen (reagen VDRL ).
o Homogenkan dengan batang pengaduk.
− Putar pada rotator kecepatan 100 rpm selama 4-8 menit.
− Amati ada tidaknya flokulasi.
b) Kuantitatif
o Siapkan alat dan bahan yang dibutuhkan.
o Lakukan pengenceran berseri pada slide dengan cara 50 ul serum + 50 ul saline
dihomogenkan kemudian hari campuran ini dipipet 50 ul dan diletakkan
pada lingkaran ke dua pada slide yang sama kemudian tambahkan 50 ul salin dan
homogenkan kembali lalu lakukan hal yang sam seperti pada lingkaran pertama
sampai lingkaran terakhir dima pada pengenceran terakhir hasil pengenceran
dibuang sebanyak 50 ul. Maka hasil pengenceran adalah 1/2 , 1/4 , 1/8, 1/16,
1/32, 1/64, 1/128.
o Kepada masing-masing pengenceran tambahkan 1 tetes ( 50 ul ) antigen VDRL (
reagen).
o Kemudian dihomogenkan dan diputar dengan rotator kecepatan 100 rpm selam
5-8 menit.
o Amati ada tidaknya flokulasi setiap pengenceran dan tentukan titer
pemeriksaannya ( yaitu pengenceran trerakhir yang masih menunjukkan
flokulasi )
g. Interpretasi Hasil
c) Kualitatif
Hasil pengamatan cukup menyebutkan non-reaktif, reaktif lemah atau reaktif
Gambar . Interpretasi hasil Pemeriksaan VDRL
Keterangan :
REAKTIF : Bila tampak gumpalan sedang atau besar
REAKTIF LEMAH: Bila tampak gumpalan kecil-kecil
NON REAKTIF : Bila tidak tampak flokulasi/gumpalan
d) Kuantitatif
Tentukan titernya (amati pngenceran trakhir yang masih menunjukkan flokulasi),
misalnya 1/64.
Pemeriksaan TPHA
1) Tujuan : Untuk mendeteksi adanya antibody terhadap Treponema palidum dalam
serum dan plasma pasien secara kualitatif dan semi-kuantitatif
2) Metode Pemeriksaan : Hemaaglutinasi tidak langsung (indirek hemaaglutinasi)
3) Prinsip Pemeriksaan : adanya antibodi Treponema palidum akan bereaksi dengan
antigen treponemal yang menempel pada eritrosit ayam kalkun/ domba sehingga
terbentuk aglutinasi dari eritrosit-eritrosit ini .
Gambar .Prinsip Uji TPHA
4) Spesimen Pemeriksaan : Serum
5) Alat dan Bahan Pemeriksaan
1) Mikroplate tipe U
2) Mikropipet (25µL , 75µl dan 100µL)
3) Automati vibrator
4) Reagen kit TPHA (R1 : Test sel - R2 : Control sel - R3 : Diluent - R4 : Control positif
- R5 : Control negatif)
6) Cara Kerja
e) Kualitatif
a) Alat dan bahan disiapkan
b) Setiap komponen kit dan sampel dikondisikan pada suhu kamar.
c) Semua reagen dihomogenkan perlahan.
d) Diluents ditambahkan sebanyak 190 µl dan sampel ditambahkan sebanyak 10µl
pada sumur 1 lalu dihomogenkan
e) Campuran pada sumur 1 dipipet sebanyak 25 µl dan ditambahkan pada sumur 2
dan 3
f) Control sel sebanyak 75 µl ditambahkan pada sumur 2 lalu dihomogenkan.
g) Test sel sebanyak 75 µl ditambahkan pada sumur 3 lalu dihomogenkan
h) Sumur diinkubasi pada suhu ruang selama 45 – 60 menit.
i) Aglutinasi yang terjadi diamati.
j) Sampel yang menunjukan hasil aglutinasi positif dilanjutkan ke uji semi kuantitatif.
Catatan : control positif dan negatif selalu disertakan dalam setiap uji tanpa perlu
diencerkan.
f) Kuantitatif
o Alat dan bahan disiapkan.
o Setiap komponen kit dan sampel dikondisikan pada suhu kamar.
o Semua reagen dihomogenkan perlahan.
o Sumur mikrotitrasi disiapkan dan diberi label no. 1 sampai 8.
o Pengenceran sampel dibuat pada sumur yang berbeda dengan sumur mikrotitrasi
dengan mencampur 190 µl diluents dan 10 µl sampel
o Sumur mikrotitrasi no. 1 dikosongkan
o Sumur mikrotitrasi no. 2 – 8 ditambahkan 25µl diluent
o Pada sumur mikrotitrasi no. 1 dan 2 ditambahkan 25 µl sampel yang telah
diencerkan.
o Campuran pada sumur 2 dipipet 25 µl dan ditambahkan pada sumur 3, lalu
dihomogenkan. Begitu seterusnya sampai sumur 8.
o Campuran pada sumur 8 dipipet 25 µl dan dibuang
o Control sel sebanyak 75 µl ditambahkan pada sumur mikrotitrasi no. 1 lalu
dihomogenkan.
o Tes sel sebanyak 75 µl ditambahkan pada sumur mikrotitrasi no. 2-8 lalu
dihomogenkan.
o Sumur diinkubasi pada suhu ruang selama 45 – 60 menit.
o Aglutinasi yang terjadi dibaca, dan ditentukan titernya
7) Interpretasi Hasil
g) Kualitatif
Hemaglutinasi positif ditandai dengan adanya bulatan berwarna merah dipermukaan
sumur, hasil negatif terlihat seperti titik berwarna merah di tengah dasar sumur.
Derajat hemaglutinasi :
+4 : bulatan merah merata pada seluruh permukaan sumur
+3 : bulatan merah ada di sebagian besar permukaan sumur
+2 : bulatan merah yang terbentuk tidak besar dan tampak seperti cincin
+1 : bulatan merah kecil dan tampak cincin terang
+/- : tampak cincin dengan warna bulatan merah yang samar
- : Tampak titik berwarna merah didasar sumur
Gambar 5.24 Derajat Hemaglutinasi pemeriksaan TPHA
h) Kuantitatif
Titer : pengenceran tertinggi yang masih menunjukkan aglutinasi
Sumur 1 2 3 4 5 6 7 8
Titer Control
cell
1/80 1/160 1/320 1/640 1/1280 1/2560 1/5120
Glosarium
Open Reading Frame (ORF) : bagian dari susunan DNA yang siap ditranslasikan tanpa kodon
stop, sehingga protein yang dihasilkan dalam jumlah besar (overexpression.
Nucleid Acid Test (NAT) : teknik molekuler yang dipakai untuk menyaring darah donor
dengan tujuan mengurangi infeksi yang ditularkan lewat transfusi darah pada pasien.
Colodial gold conjugate : merupakan molekul yang tersusun dari beberapa partikel koloid
emas yang bermuatan negatif dan memiliki afinitas kuat untuk beberapa protein yang
cenderung bermuatan positif, pH netral atau fisiologis.
Bab 6
PEMERIKSAAN IMUNOHEMATOLOGI
(PEMERIKSAAN PRE TRANSFUSI)
Transfusi darah merupakan ilmu tentang golongan darah manusia dalam hubungannya
dengan proses pemindahan darah / komponen-komponen darah dari donor kepada resipien.
Dalam bab ini akan dibahas tentang pemeriksaan Imunohematologi atau yang lebih dikenal
sebagai pemeriksaan pre-transfusi, diantaranya pemeriksaan golongan darah ABO & Rhesus,
Crossmatch, Coomb’s Test, skrining dan identifikasi antibodi. Tujuan pemeriksaan pre-
transfusi adalah memilih darah atau komponen darah yang kompatibel, sehingga dapat
menyelamatkan jiwa seseorang dengan tidak merusak darah pasien atau merugikan pasien.1
Selama pemeriksaan ada beberapa hal yang harus diperhatikan dalam pemeriksaan
pretransfusi, antara lain :
A. Sampel darah pasien.
Apabila pasien memerlukan transfusi darah, maka pasein harus diambil darah sekitar
5-10 mL yang dimasukkan ke dalam tabung kering untuk mendapatkan serum / plasma
yang cukup banyak sebagai bahan pemeriksaan pre-transfusi. Selain itu sampel harus
diberi pengenal yang jelas, meliputi nama pasien, tanggal lahir pasien dan nomor
registrasi/barcode pasien. Kemudian dikirim secepatnya ke laboratorium bersamaan
dengan formulir permintaan darah.
Pengambilan sampel darah pasien dengan pemberian label yang benar merupakan hal
kritis yang perlu diperhatikan. Apabila ada contoh darah pasien yang tidak memiliki
identitas yang jelas, maka harus mengambil contoh darah pasien baru untuk
mengabsahkan identitas pasien. Selain itu sampel darah pasien tidak boleh hemolisis,
karena dapat mengganggu pemeriksaan pre transfusi.
B. Formulir permintaan darah
Formulir permintaan darah harus ditandatangani oleh dokter yang merawt pasien.
Formulir permintaan darah berisikan informasi sebagai berikut :
1) Tanggal permintaan
2) Nama lengkap pasien
3) Tanggal lahir atau usia
4) Jenis kelamin
5) Nomor registrasi rumah sakit
6) Ruang rawat / bangsal
7) Alamat pasien
8) Diagnosis pasien
9) Golongan darah apabila sudah diketahui.
10) Keberadaan setiap antibodi, apabilah telah diketahui
11) Riwayat transfusi sebelumnya
12) Riwayat reaksi transfusi.
13) Jumlah dan jenia darah atau produk darah yang dibutuhkan.
14) Tanggal dan waktu dibutuhkan.
15) Tanda tangan dokter yang meminta darah.
Catatan : Lakukan konfirmasi identitas sampel darah pasien di bank darah.
C. Penyimpanan sampel darah
Sampel darah pasien dan donor harus ditutp dan disimpan dengan baikpada suhu 2-6°C
minimal 7 hari setelah transfusi, tujuannya untuk pemeriksaan ulang apabila ada laporan
terjadinya reaksi transfusi.
D. Pendataan
Setiap permintaan darah dan pemeriksaan darah harus ada pendataan yang lengkap, agar
dapat dilakukan penelusuran kembali bila dibutuhkan sewaktu-waktu.
E. Pemeriksaan pre transfusi
pemeriksaan pre-transfusi pada sampel darah donor dan pasien yang meliputi
pemeriksaan golongan darah ABO & Rhesus, Crossmatch, Coomb’s Test, skrining dan
identifikasi antibodi
Pada Bab ini mahasiswa akan melalukan praktikum Imunohematologi, untuk itu
mahasiswa diwajibkan mematuhi tata tertib Praktikum di laboratorium, sebagai berikut
:Larangan :
a) Dilarang makan, minum, dan merokok selama praktikum di laboratorium.
b) Dilarang membuang sampah ke dalam wastafel / meja kerja dan di dalam ruangan
laboratorium.
c) Dilarang membawa telepon genggam / handphone selama praktikum, kecuali memakai
cover / plastik disposible.
Kewajiban :
a) Praktikan harus menggunakan alat pelindung diri (APD) selama praktikum di
laboratorium.
b) Praktikan harus mengisi daftar hadir dan melaporkan hasil pengamatan kepada dosen /
asisten pengawas praktikum.
c) Praktikan harus melaporkan setiap kerusakan alat yang dipakai dan menggantinya
dengan spesifikasi yang sesuai.
d) Bersihkan sisa praktikum pada setiap meja / wastafel tempat Anda bekerja.
e) Peralatan yang telah selesai dipakai dikembalikan pada dosen pengawas dalam keadaan
bersih dan kering.
f) Setiap kelompok praktikum diwajibkan membawa kain lap bersih / tisu, kertas label, dan
spidol permanen.
g) Untuk persiapan sebelum praktikum dan pengawasan alat setelah praktikum, dosen
pengawas akan dibantu oleh kelompok piket yang bertugas secara bergantian setiap
minggunya.
Topik 1
Persiapan Alat, Reagensia dan Sampel
A. PERSIAPAN ALAT
Peralatan yang diperlukan untuk pemeriksaan imunohematologi / pretransfusi,
diantaranya :
1. Sentrifuse untuk pemisahan darah menggunakan tabung reaksi (table top centrifuge).
2. Sentrifuse untuk pemeriksaan golongan darah metode tabung (serological centrifuge).
3. Sentrifuse untuk pemeriksaan metode gel tes (gel test centrifuge).
4. Inkubator 37°C (waterbath atau dry incubator)
5. Inkubator 37° untuk pemeriksaan gel tes
6. Lemari es (refrigerator)
7. Tabung reaksi ukuran 12 x 7,5 mm
8. Rak tabung reaksi
9. Pipet pasteur plastik
10. Blood Grouping Plate (BGP)
11. Coomb gel tes
12. Pipet adjustable ukuran 200 – 1000 µL
13. Pipet adjustable ukuran 5 – 50 µL
14. Tissue
15. Objek glass
16. Mikrokop
17. Tips kuning
18. Tip Biru
19. Label
20. Spidol permanen
21. Kontainer / wadah penampung
22. Sarung tangan
23. Masker
24. Jas laboratorium
25. Gunting
26. Kantung plastik limbah.
B. PERSIAPAN REAGENSIA
Bahan dan Reagen yang diperlukan untuk pemeriksaan imunohematologi / pretransfusi,
diantaranya :
a. Sampel darah pasien
b. Sampel darah donor
c. Anti-A
d. Anti-B
e. Anti-D IgM
f. Anti-D IgG
g. Bovine albumin 22% dan 6%
h. Anti Human Globulin / Serum Coombs
i. Larutan saline (0,9%)
j. Aquadest
k. Larutan alseiver
l. Low Ionic Strenght Saline (LISS) : Larutan garam faali 0,2% dan larutan sukrosa 7%
m. Desinfektan (hipochlorit 0,5%)
n. Detergen
C. PERSIAPAN SAMPEL
Preparasi contoh darah harus dilakukan sebelum melakukan pemeriksaan lebih lanjut
untuk mendapatkan hasil pemeriksaan yang optimal. Ada beberapa hal yang harus
diperhatikan dalam hal ini, diantaranya :
1) Pemisahan serum / plasma dari sel darah
1) Prinsip : Darah sitrat / darah EDTA dengan pemutaran akan terjadi pemisahan
antara plasma dan sel-sel darah.
2) Tujuan : Memisahkan plasma dari sel-sel darah
3) Kegunaan :
1) Persiapan pembuatan suspensi darah
2) Persiapan penentuan antigen golongan darah
4) Cara Kerja :
1
-- Siapkan contoh darah dengan antikoagulan EDTA dalam tabung.
-- Sentrifugasi darah dalam tabung dengan kecepatan 3000 rpm selama 2 menit.
-- Siapkan 1 tabung yang bersih untuk menampung plasma.
-- Pisahkan plasma sebanyak-banyaknya dari sel darah merah pekat dan masukan
ke dalam tabung yang sudah disiapkan.
-- Beri identitas pada masing-masing tabung sel darah merah pekat dan plasma
Gambar 6.1 Skema pemisahan serum/plasma daeri sel darah merah
2) Pencucian sel darah merah
5) Prinsip : Dengan penambahan larutan saline (NaCl 0,9%) dan pemutaran maka
antibodi di sekitar sel darah merah akan hilang..
6) Tujuan :
1. Menghilangkan sisa protein pada sel darah merah
2. Menghilangkan sel-sel darah yang rapuh
3. Menghilangkan auto cold antibody
4. Menghilangkan formasi Rouleaux
7) Kegunaan :
1. Persiapan pembuatan suspensi darah
2. Persiapan penentuan antigen golongan darah
8) Cara Kerja :
a) Lakukan pencucian sel darah merah pekat dengan mengambil ± 8 tetes dan
masukan kedalam tabung reaksi 12 x 75 mm.
b) Tambahkan NaCl 0,9% (saline) sebanyak ± 4,5ml atau sampai ¾ tabung kedalam
sel darah merah pekat tadi.
c) Tutup tabung dengan parafilm, kocok dengan perlahan agar larutan menjadi
homogen.
d) Sentrifugasi dengan kecepatan 3000 rpm selama 2 menit.
e) Buka penutup parafilm dan buang supernatan dengan menggunakan pipet
(pencucian ke 1).
f) Lakukan pencucian sebanyak 3 kali dengan mengulangi langkah ke b hingga ke e
sesuai kebutuhan.
g) Sel darah merah yang sudah dicuci merupakan suspensi 100 %.
Gambar 6.2 Skema pencucian sel darah merah
3) Pembuatan suspensi sel darah merah
Sel darah merah yang sudah dicuci kemudian dibuat suspensi yang sesuai kebutuhan,
yaitu :
Tabel 21. Pembuatan Suspensi Sel Darah Merah
% Suspensi
Suspensi
SEL DARAH
MERAH
100%
Medium
(Larutan Saline)
Penggunaan
5%
(1/20)
1 bagian a) bagian a) Pemeriksaan golongan darah (tube
test)
b) Pemeriksaan silang serasi
(crossmatching)
1
10%
(1/10)
1 bagian 9 bagian Pemeriksaan golongan darah ABO (slide
test/bioplate)
40%
(2/5)
1 bagian 3 bagian Pemeriksaan golongan darah rhesus
(slide test/ bioplate)
4) Untuk pembuatan Test Sel Golongan darah A,B,O untuk pemeriksaan antibodi pada serum,
dilakukan pooling dari darah donor suspensi 100% yang telah diketahui golongan darahnya :
1 Test Sel A => Dibuat dari 3 golongan darah A yang di pooling sama banyak (A1, A2, A3),
kemudian dibuat suspensi 5% dan 10% .
2 Test Sel B => Dibuat dari 3 golongan darah B yang di pooling sama banyak (B1, B2, B3),
kemudian dibuat suspensi 5% dan 10%.
3 Test Sel O => Dibuat dari 3 golongan darah O yang di pooling sama banyak (O1, O2, O3),
kemudian dibuat suspensi 5% dan 10%.
Tabel 22. Cek List Perawatan Contoh Darah
Memisahkan serum/plasma dengan sel darah merah
Contoh darah dalam tabung
↓
Putar 3000 rpm selama 2 menit
↓
Hasil → supernatan dan sedimen sel
↓
Siapkan 2 tabung beri label
↓
Pisahkan supernatan (plasma/serum) kedalam tabung
↓
Serum jernih dan sek darah merah pekat
↓
Sel darah merah pekat
Pencucian sel darah merah pekat dengan saline
Sel darah merah pekat dengan ambil ± 8 tetes
↓
Tambahkan NaCl 0,9% (saline) sebanyak ± 4,5mL atau sampai ¾ tabung
↓
Tutup tabung dengan parafilm
↓
kocok perlahan agar larutan homogeny (bolak balik tabung)
↓
Putar 3000 rpm selama 2 menit
↓
Buka penutup →buang supernatan saline (pencucian I)
↓
Lakukan pencucian sebanyak 3 kali dengan mengulangi point 2-6
↓
Hasil →sel darah merah pekat 100% yang bebas protein/globulin (WPRC)
5) PembuatanCOOMB’S CONTROL CELLS (CCC)
COOMB’S CONTROL CELLS (CCC) adalah suspensi sel darah merah golongan O Rhesus
positif yang sudah disensitasi (dicoated) oleh anti –D IgG ( inkomplit).
1. Tujuan :
a) Dapat menguji reagen Coomb’s Serum, masih valid/ invalid
b) Dapat menguji hasil negative dari pemeriksaan uji silang, Direct Coomb’s Test dan
indirect Comb’s Test, hasil negative ini valid/invalid.
2. Prinsip : Antigen + antibodi D IgG (inkomplit)→ Antigen sensitasi ( coated ) antibodi D
inkomplit
3. Metoda: Tube test
4. Pembuatan Coomb’s Control Cells :
-- Nyalakan dan atur suhu inkubator pada 37⁰C.
-- Siapkan reagensia pada suhu kamar sebelum dipakai dan disimpan kembali pada
suhu 2⁰C - 8⁰C setelah dipakai .
-- Siapkan contoh darah yang memakai antikoagulan golongan O Rhesus positif.
-- Pembuatan suspensi sel 5%, 40% dari darah golongan O Rhesus positif
-- Pemeriksaan titer anti-D IgG ( inkomplit )
a) Siapkan 10 tabung reaksi masing-masing tabung beri indentitas : ½, ¼, 1/8, 1/16,
1/32, 1/64, 1/128, 1/256, 1/512, 1/1024
b) Tabung 1 s/d 10 teteskan saline sebanyak 2 tetes.
c) Isi tabung no.1 teteskan anti-D IgG sebanyak 2 tetes.
d) Kocok perlahan dengan menggunakan pipet, ambil 2 tetes campuran masukan
kedalam tabung no.2
e) Lakukan pemindahan enceran berkala sampai tabung no.10, pada tabung no. 10
buang 2 tetes enceran anti-D tsb.
f) Kocok semua tabung hingga cairan tercampur
g) Inkubasi pada suhu 37⁰C selama 15 menit semua tabung
h) Angkat semua tabung, putar 3000rpm selama 15”, baca hasil reaksi.
i) Tabung yang hasilnya negative dicuci sebanyak 3x dengan saline
j) Pada pencucian terakhir buang supernatant sebanyak banyaknya.
k) Tambahkan 2 tetes comb’s serum (AHG).
l) Kocok perlahan hingga cairan tercampur
m) Putar 3000rpm Selama 15”, baca hasil reaksi
Tabel 23. Lembar hasil titer anti – D IgG ( inkomplit ).
Tabung
1 2 3 4 5 6 7 8 9 10
½ ¼ 1/8 1/16 1/32 1/64 1/128 1/256 1/512 1/1024
37⁰C
selama 15
menit
neg Neg Neg Neg Neg Neg Neg Neg Neg Neg
Hasil
(contoh)
4+ 4+ 3+ 3+ 2+ + + Neg Neg Neg
a) Membuat enceran anti –D IgG yang dipakai adalah dengan hasil kekuatan titer : 2. Yaitu
pada titer 32.
b) Suspensi yang dipakai adalah suspensi 40% agar tidak telalu banyak dalam
penetesan.
Tabel 24. Modifikasi Suspensi Sel Darah Merah Untuk Pembuatan CCC
Suspensi sel darah merah
( modifikasi )
Enceran anti-D IgG dengan saline
5% 32 → 1 tetes anti-D IgG + 31 saline
10 % 16 → 1 tetes anti-D IgG + 15 saline
40% f) → 1 tetes anti-D IgG + 7 saline
− Buatlah suspensi sel O Rh positif (yang sudah dicuci 1 kali) menjadi 40% dalam saline
− Buat pengenceran anti –D (IgG) dengan titer 1:7 dalam saline.
− Kedalam enceran anti –D, tambahkan suspensi sel O Rh positif 40% sebanyak 4 tetes.
− Kocok perlahan hingga tercampur, inkubasi 37⁰C selama 15 menit (coated/sensitasi).
− Putar 2 menit 3000rpm kemudian supernatant dibuang.
− Cuci selnya dengan saline sebanyak 3x .
− Endapan sel darah merah dibuat suspensi 5% → Coomb’s Control Cells (CCC) akan
diperoleh 32 tetes CCC dengan perhitungan sebagai berikut :
P1 . V1 = P 2 . V 2
40% . 4 tetes = 5% . V 2
V 2 = 32 tetes
− Jika saline yang tersisa di tabung sekitar 3 tetes, maka saline yang ditambahkan
sebanyak 29 tetes.
- VALIDASI REAGEN
Pereaksi atau sering disebut juga reagensia (inggris : reagent) adalah suatu zat
yangberperan dalam suatu reaksi kimia atau diterapkan untuk tujuan analisis. Istilah reagen
jugadipakai untuk menunjuk pada zat kimia dengan kemurnian yang cukup untuk sebuah
analisisatau percobaan. Sebelum dipakai untuk analisis, suatu reagen harus melalui proses
validasi dahulu untuk mengetahui kualitas dari reagen ini . Validasi reagen adalah suatu
tindakanyang dilakukan untuk menunjukan tingkat kevalidan atau kesahihan suatu reagen.
Validasi reagen merupakan salah satu pemantapan mutu internal. Pemantapan mutu internal
adalah kegiatan pencegahan dan pengawasan yang dilaksanakan oleh setiap laboratorium
secara terus-menerus agar diperoleh hasil pemeriksaan yang tepat.
Uji validitas reagen adalah suatu langkah pengujian yang dilakukan terhadap isi
(content)dari suatu reagen, dengan tujuan untuk mengukur ketepatan reagen yang dipakai
dalam suatu pemeriksaan. Untuk mengetahui apakah tes itu valid atau tidak harus dilakukan
melalui pengujian dari reagen itu sendiri agar hasil dari pemeriksaan dapat berlangsung
dengan baik dan benar. Dengan melakukan uji validitas reagen juga bermanfaat untuk
mengetahui kondisi reagen.
Jadi, tujuan validasi reagen adalah untuk menguji validitas suatu reagen sehingga dapat
diketahui kualitas dari reagen sebelum dipakai untuk pemeriksaan dan juga untuk
menetapkan reagen yang dipakai valid atau invalid sehingga diperoleh hasil pemeriksaan
yang akurat. Oleh karena itu, validitas reagen penting dilakukan sebelum melakukan
pemeriksaan menggunakan reagen ini .
Dalam praktikum ini, dilakukan uji validitas reagen, khususnya reagen yang dipakai
pada pemeriksaan golongan darah untuk tujuan transfusi darah. Uji kualitas reagen harus
dilakukan pada:
a) Setiap kali batch larutan kerja (working solution) dibuat.
b) Setiap minggu
c) Bila sudah mendekati masa kadaluarsa
d) Bila ditemukan/terlihat tanda tanda kerusakan ( timbul kekeruhan, perubahan warna,
timbul endapan)
e) Bila ada kecurigaan hasil pemeriksaan
Reagen yang akan divalidasi dalam praktikum ini adalah
1. antisera A,B dan D
2. test sel ABO
3. Bovine Albumin 22%
4. Comb’s Serum
5. CCC ( Comb’s Control Cell)
Sebelum memulai proses validasi, masing-masing reagen